题目内容
1.(1)铝制品具有良好抗腐蚀性的原因是表面有致密的氧化物保护膜.(2)区别氯化铁溶液与氢氧化铁胶体的实验名称是丁达尔实验.
(3)除去FeCl2溶液中的FeCl3:往混合液中加入适量铁粉,并进行过滤操作.写出反应的化学方程式:2FeCl3+Fe═3FeCl2.
分析 (1)Al表面的氧化铝,为致密的结构具有防腐作用;
(2)氢氧化铁胶体具有丁达尔现象;
(3)Fe能与氯化铁反应生成氯化亚铁,可用于除杂,以此解答该题.
解答 解:(1)Al表面的氧化铝,为致密的结构,从而具有良好抗腐蚀性,
故答案为:表面有致密的氧化物保护膜;
(2)氢氧化铁胶体具有丁达尔现象,而溶液不具有,则区别氯化铁溶液与氢氧化铁胶体的实验名称是丁达尔实验,
故答案为:丁达尔;
(3)因为铁离子能和铁反应生成亚铁离子,化学方程式为2FeCl3+Fe═3FeCl2,故可用铁除去FeCl2溶液中的少量氯化铁,除去FeCl2溶液中的FeCl3:往混合液中加入适量铁粉并进行过滤操作,
故答案为:过滤;2FeCl3+Fe═3FeCl2.
点评 本题考查较综合,涉及Al的化学性质、氧化铝的性质、铝及其化合物性质等,侧重元素化合物性质的考查,注重化学与环境保护、生活的联系,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
20.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
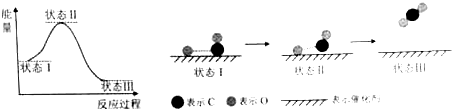
下列说法中正确的是( )

下列说法中正确的是( )
| A. | CO和O生成CO2是吸热反应 | B. | 在该过程中,CO断键形成C和O | ||
| C. | CO和O生成了具有极性共价键的CO2 | D. | 催化剂可改变该反应的焓变 |
17. 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )
 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2O(g)?CH3OH(g)达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化曲线如图所示.则下列结论正确的是( )| A. | 反应CO(g)+2H2O(g)?CH3OH(g)的△H<0 | |
| B. | 图示a点n(CO):n(H2)=0.5,CO转化率最高 | |
| C. | 若在状态Ⅰ和Ⅱ时,再向体系中充入He,重新达到平衡,c(CH3OH,状态Ⅱ)=c(CH3OH,状态Ⅰ) | |
| D. | 正反应速率v正:v正(状态Ⅱ)<v正(状态Ⅲ) |
4.W、X、Y、Z为原子序数依次增大的同周期的短周期元素.已知W、Y、Z三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水.下列判断正确的是( )
| A. | W、Y、Z三种元素的最高价氧化物的水化物可能有两种是强碱、一种是强酸 | |
| B. | Z元素在第三周期第ⅥA族 | |
| C. | W、Y、Z三种元素有两种是金属、一种是非金属 | |
| D. | W、X、Y三种元素的单质熔沸点依次降低 |
13.下列说法不正确的是( )
| A. | 在酸性条件下,CH3CO18 OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| B. | 乙醛和丙烯醛不是同系物,它们与H2充分反应后的产物是同系物 | |
| C. | 用溴水可以鉴别苯酚溶液、2,4-己二烯、甲苯和CCl4 | |
| D. | 乳酸薄荷醇酯(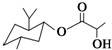 )能发生水解反应、氧化反应、消去反应、取代反应 )能发生水解反应、氧化反应、消去反应、取代反应 |
11.某学生鉴定甲盐溶液的流程如图所示,下列说法正确的是( )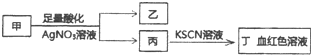

| A. | 若乙为白色沉淀,则甲可能含有SiO32- | |
| B. | 若乙为黄色沉淀,则甲可能为FeI3 | |
| C. | 若乙为浅黄色沉淀,则甲可能含有S2- | |
| D. | 若乙为浅黄色沉淀,则甲可能是FeBr2 |

 Ⅰ.一定条件下,O2可通过得失电子转化为O2-、O2+ 和O22-.
Ⅰ.一定条件下,O2可通过得失电子转化为O2-、O2+ 和O22-.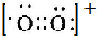 .
.