题目内容
6.按图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68克,溶液质量增加0.03克,则A合金中Cu、Zn原子个数比为BA、4:1 B、3:1 C、2:1 D、任意比.
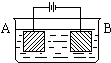
分析 该装置是电解池,阳极上金属失电子发生氧化反应,阴极上铜离子得电子发生还原反应,所以阴极上增加的质量是铜的质量,溶液中增加的质量为溶解锌的质量与通过相同电子时析出铜的质量差,根据质量差可以计算溶解的锌的物质的量,再根据氧化还原反应中得失电子数相等计算合金上铜的物质的量,从而计算铜和锌的原子个数之比.
解答 解:B极上析出的是铜,B极质量增加7.68g,其物质的量=$\frac{7.68g}{64g/mol}$=0.12mol;
阳极上溶解锌时,阴极上析出铜,所以溶液质量增加的质量为锌和铜的质量差,溶液质量增加0.03g,即锌和铜的质量差为0.03g.
设锌的物质的量为x.
Zn+Cu2+=Zn2++Cu 质量增加
1mol 1g
x 0.03g
x=0.03mol,即合金中锌的物质的量是0.03mol.
根据氧化还原反应中得失电子数相等知,阳极上锌和铜失去的电子数等于阴极上铜离子得到的电子,设铜的物质的量为y.
0.03mol×2+2y=0.12mol×2,y=0.09mol,所以铜和锌的物质的量之比为0.09mol:0.03mol=3:1,所以铜和锌的原子个数之比是3:1,故选B.
点评 本题以原电池原理为载体考查了物质的量的有关计算,明确溶液中质量增加的量是什么是解本题的关键,然后根据得失电子数相等计算铜的物质的量,从而确定铜和锌的个数之比.

练习册系列答案
相关题目
5.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 明矾是常用的水处理剂,可以用来淡化海水 | |
| B. | 患有胃溃疡的病人的胃酸过多,可以用小苏打医治 | |
| C. | 生活中常用的铝制品与不锈钢制品不易腐蚀,其原理不同 | |
| D. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用完全相同 |
2.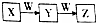 X、Y、Z、W均为中学化学常见物质,且X、Y、Z含有同一种元素,在一定条件下发生如图所示的转化关系,则W不可能是( )
X、Y、Z、W均为中学化学常见物质,且X、Y、Z含有同一种元素,在一定条件下发生如图所示的转化关系,则W不可能是( )
 X、Y、Z、W均为中学化学常见物质,且X、Y、Z含有同一种元素,在一定条件下发生如图所示的转化关系,则W不可能是( )
X、Y、Z、W均为中学化学常见物质,且X、Y、Z含有同一种元素,在一定条件下发生如图所示的转化关系,则W不可能是( )| A. | Al | B. | Si | C. | O2 | D. | Fe |
11.向某无色溶液中加入氢氧化铝,氢氧化铝迅速溶解,则该溶液中一定能够大量共存的离子组是( )
| A. | K+、Ba2+、N${O}_{3}^{-}$、Cl- | B. | Na+、N${H}_{4}^{+}$、S${O}_{4}^{2-}$、Cl- | ||
| C. | Na+、H+、C${O}_{3}^{2-}$、N${O}_{3}^{-}$ | D. | Na+、K+、Mn${O}_{4}^{-}$、Br- |
15.下列物质溶于水所得溶液呈酸性的是( )
| A. | NH3 | B. | NaCl | C. | NaHCO3 | D. | SO2 |
16.下列有关氮元素及其化合物的表示正确的是( )
| A. | 质子数为7、中子数为8的氮原子:${\;}_{7}^{8}$N | |
| B. | 氮原子的结构示意图: | |
| C. | 氨分子的电子式: | |
| D. | 对硝基甲苯的结构简式:NO2CH3 |
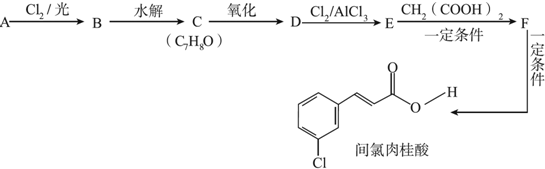
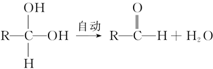
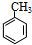 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$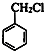 +HCl.
+HCl.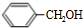 +CH3COOH$→_{△}^{浓硫酸}$
+CH3COOH$→_{△}^{浓硫酸}$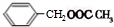 +H2O.
+H2O.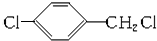 .
.