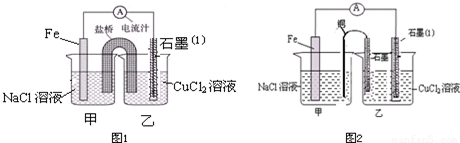
题目内容
11.某学生鉴定甲盐溶液的流程如图所示,下列说法正确的是( )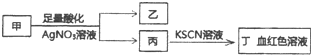
| A. | 若乙为白色沉淀,则甲可能含有SiO32- | |
| B. | 若乙为黄色沉淀,则甲可能为FeI3 | |
| C. | 若乙为浅黄色沉淀,则甲可能含有S2- | |
| D. | 若乙为浅黄色沉淀,则甲可能是FeBr2 |
分析 因酸性条件下,硝酸根离子具有强氧化性,丙中加入KSCN后溶液为血红色,应含有Fe3+,说明甲中含有Fe2+或Fe3+,甲盐中加入适量硝酸银溶液生成浅黄色沉淀,可能为S或AgBr,若乙为白色沉淀,应生成AgCl,以此解答该题.
解答 解;A.若甲含有SiO32-,则与Fe2+或Fe3+不能稳定共存,故A错误;
B.Fe3+可与碘离子发生氧化还原反应,甲不能为FeI3,故B错误;
C.甲中含有Fe2+或Fe3+,如含有S2-,则生成沉淀,不能稳定存在于溶液中,故C错误;
D.如甲为FeBr2,加入硝酸银,可生成AgBr黄色沉淀,酸性条件下Fe2+被氧化生成Fe3+,加入KSCN变红色,故D正确.
故选D.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
2.用于焊接钢轨的反应为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,该反应属于( )
| A. | 化合反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |
19.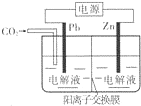 采用电化学法还原CO2是一种使CO2资源化的方法,下图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )
采用电化学法还原CO2是一种使CO2资源化的方法,下图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )
 采用电化学法还原CO2是一种使CO2资源化的方法,下图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )
采用电化学法还原CO2是一种使CO2资源化的方法,下图是利用此法制备ZnC2O4的示意图(电解液不参与反应).下列说法正确的是( )| A. | Zn与电源的负极相连 | |
| B. | ZnC2O4在交换膜右侧生成 | |
| C. | 电解的总反应为:2C02+Zn$\frac{\underline{\;电解\;}}{\;}$ZnC2O4 | |
| D. | 通入11.2 L CO2时,转移0.5 mol电子 |
16.下列有关氮元素及其化合物的表示正确的是( )
| A. | 质子数为7、中子数为8的氮原子:${\;}_{7}^{8}$N | |
| B. | 氮原子的结构示意图: | |
| C. | 氨分子的电子式: | |
| D. | 对硝基甲苯的结构简式:NO2CH3 |
3.下列指定反应的离子方程式正确的是( )
| A. | 用强碱溶液吸收硝酸工业的尾气:NO+NO2+2OH-═2NO2-+H2O | |
| B. | NH4HCO3溶液与足量NaOH溶液共热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NH3↑+2H2O | |
| C. | 明矾净水:Al3++3H2O═Al(OH)3↓+3H+ | |
| D. | 苯酚加入NaHCO3溶液中:C6H5OH+HCO3-→C6H5O-+CO2↑+H2O |
20.下列与有机物结构、性质相关的叙述错误的是( )
| A. | 蛋白质和油脂都属于高分子化合物,一定条件下都能水解 | |
| B. | 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 | |
| C. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |