题目内容
11.某同学通过以下装置测定M 样品(只含Fe、Al、Cu)中各成分的质量分数.取两份质量均为m g 的M 样品,按实验1(如图1)和实验2(如图2)进行实验,该同学顺利完成了实验并测得气体体积分别为V1mL 和V2mL(已折算到标准状况下).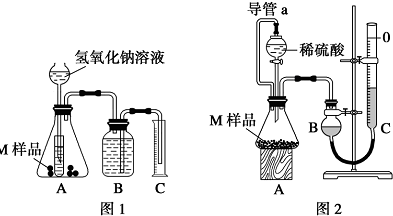
(1)实验1 装置中小试管的作用是液封,避免氢气从长颈漏斗中逸出,控制加氢氧化钠溶液的体积来控制反应的快慢,节省药品
(2)对于实验2,平视读数前应依次进行的两种操作是:冷却到室温;调整BC液面相平
(3)实验1 进行实验前,B 瓶中水没有装满,使测得气体体积无影响 (填“偏大”、“偏小”或“无影响”,下同);若拆去实验2 中导管a,使测得气体体积偏大
(4)该实验需要0.50mol•L-1 的NaOH 溶液470mL,请回答下列问题
①配制时应称量 g NaOH,配制过程所需仪器小烧杯(或称量瓶)、药匙 (填仪器名称).
②配制NaOH 溶液时,NaOH 固体中含有Na2O 杂质会导致所配溶液浓度偏大.(填“偏大”、“偏小”或“无影响”).
(5)该实验中所用稀硫酸是用98%的浓硫酸(ρ=1.84g/cm3)配制的,若将该浓硫酸与等质量的水混合,则所得溶液中溶质物质的量浓度< 9.2mol/L(填>、<、=)
分析 据题意,M只含铁、铝、铜三种金属中的两种或三种,其中铝既能与强酸反应,又能与强碱反应;铁只能溶于强酸,不溶于强碱;铜既不溶于氢氧化钠,也不溶于稀硫酸.
(1)实验1的装置中,小试管的作用是对长颈漏斗起到液封作用,防止氢气逸出,控制加液体量,调节化学反应速率,节省药品;
(2)对于实验2,平视读数前应等到冷却到室温,并上下移动C量气管,使B、C液面相平,其目的是使B管收集的气体压强等于外界大气压,这样读得的读数才准确;
(3)如果实验前B瓶液体没有装满水,不影响实验结果,因为理论上B管收集的气体体积等于排入C管里液体的体积;若拆去导管a,加入液体时,排出锥形瓶中部分空气,导致测定的气体体积偏大;
(4)要配制0.50mol•L-1的NaOH溶液470mL,所用容量瓶应为500mL,所以计算氢氧化钠的质量时要按500mL溶液计算,称量时氢氧化钠要放在小烧杯(或称量瓶)中进行,用药匙取药品,NaOH固体中含有Na2O杂质,氧化钠与水反应生成氢氧化钠,使得溶液中氢氧化钠偏多,据此答题;
(5)根据$\frac{1000ρw}{M}$计算该浓硫酸的物质的量浓度.该硫酸与水的密度不同,混合所得溶液的总体积不等于硫酸体积的二倍
解答 解:据题意,M只含铁、铝、铜三种金属中的两种或三种,其中铝既能与强酸反应,又能与强碱反应;铁只能溶于强酸,不溶于强碱;铜既不溶于氢氧化钠,也不溶于稀硫酸.
(1)验1的装置中,小试管的作用是对长颈漏斗起到液封作用,防止氢气逸出,控制加液体量,调节化学反应速率,节省药品;
故答案为:液封,避免氢气从长颈漏斗中逸出,控制加氢氧化钠溶液的体积来控制反应的快慢,节省药品;
(2)对于实验2,平视读数前应等到冷却到室温,并上下移动C量气管,使B、C液面相平,其目的是使B管收集的气体压强等于外界大气压,这样读得的读数才准确,
故答案为:冷却到室温;调整BC液面相平;
(3)如果实验前B瓶液体没有装满水,不影响实验结果,因为理论上B管收集的气体体积等于排入C管里液体的体积;若拆去导管a,加入液体时,排出锥形瓶中部分空气,导致测定的气体体积偏大;
故答案为:无影响;偏大;
(4)①要配制0.50mol•L-1的NaOH溶液470mL,所用容量瓶应为500mL,所以配制时应称量0.50mol•L-1×0.5L×40g/mol=10.0g NaOH,称量时氢氧化钠要放在小烧杯(或称量瓶)中进行,用药匙取药品,
故答案为:10.0;小烧杯(或称量瓶)、药匙;
②NaOH固体中含有Na2O杂质,氧化钠与水反应生成氢氧化钠,使得溶液中氢氧化钠偏多,所以会导致所配溶液浓度偏大,
故答案为:偏大;
(5)根据c=$\frac{1000ρw}{M}$可得浓硫酸的物质的量浓度为$\frac{1000×1.84g/c{m}^{3}×98%}{98g/mol}$=18.4mol/L,
硫酸与水的密度不同,设硫酸和水的体积都为1L,混合后的密度为ρ,则有混合后的硫酸的物质的量浓度为c=$\frac{\frac{18.4mol/L×1L×1000}{1.84g/mol×1000ml+1000g}}{ρ}$=0.648ρ,因ρ>$\frac{1.84+1}{2}$g/ml,所以c<0.92mol/L<9.2mol/L,
故答案为:<.
点评 本题考查了物质性质的分析判断,实验装置的理解应用,物质的量浓度溶液的配制和计算等,掌握基础是关键,题目难度中等.

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案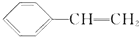 ,它一般不可能具有的性质是( )
,它一般不可能具有的性质是( )| A. | 易溶于水,不易溶于有机溶剂 | |
| B. | 在空气中燃烧产生黑烟 | |
| C. | 能使溴的四氯化碳溶液褪色 | |
| D. | 能发生加成反应在一定条件下可与4倍物质的量的氢气加成 |
| A. | 常温下,1L0.1mol•L-1CuSO4溶液中含有的Cu2+数目为0.1NA | |
| B. | 含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液NH4+为NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 25°C时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA |
| A. | 能与1molH2发生加成反应生成 | |
| B. | 易被酸性KMnO4溶液氧化而使KMnO4溶液褪色 | |
| C. | 与溴水发生加成反应而使溴水褪色 | |
| D. | 一定条件下能与H2O发生加成反生成乙醚 |
| A. | 简单离子半径:Y>Z | |
| B. | 最高价氧化物的水化物酸性:Z>Y>X | |
| C. | XY2中各原子最外层均满足8电子结构 | |
| D. | X的氢化物中化学键均为极性共价键 |
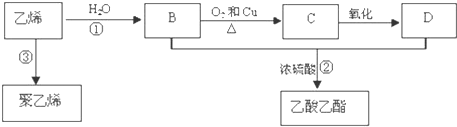
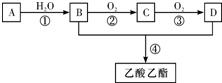
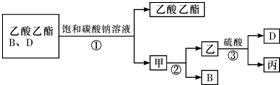
 CH3COOC2H5+H2O;③
CH3COOC2H5+H2O;③ .
.
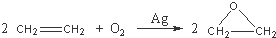
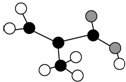 (1)经分析,某芳香族化合物A含C、H、O的质量分数分别为77.8%、7.4%、14.8%,该有机物一个分子中只含有一个氧原子.
(1)经分析,某芳香族化合物A含C、H、O的质量分数分别为77.8%、7.4%、14.8%,该有机物一个分子中只含有一个氧原子.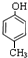 ;
;