题目内容
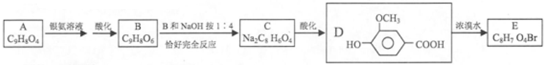
如图A、B、C、D、E五组仪器(图中a、b、c表示止水夹)可以根据需要组装成不同实验装置.某兴趣小组的同学利用这些实验仪器进行实验,请对其方案进行完善或评价.

(1)将B、C、E相连,用浓硫酸和浓盐酸可制取氯化氢,装在分液漏斗中的试剂是 ,该实验尾气吸收装置设计有何不妥? ;改正后将B、D、E装置相连,用D装置中的丁试管收集满氯化氢气体,使烧杯中的水进人试管丁的操作是 .
(2)将A、C、E相连,并在丙中加入适量水,即可制得氯水,将所得氯水分为两份,进行ⅠⅡ两个实验,实验操作、现象、结论如下表所示:
请你评价:实验I推出的相应的结论是否合理? .若不合理,请说明理由,〔若合理则无需填写) .实验Ⅱ推出的结论是否合理? .若不合理,请说明理由,(若合理则无需填写)
(3)研究表明,用ClO2气体对自来水消毒效果比用Cl2更好.市售的一种新型消毒剂含两种成分,分别是NaClO3和Na2C2O4.两种成分在溶液中混合便产生ClO2,反应的化学方程式为 .

(1)将B、C、E相连,用浓硫酸和浓盐酸可制取氯化氢,装在分液漏斗中的试剂是
(2)将A、C、E相连,并在丙中加入适量水,即可制得氯水,将所得氯水分为两份,进行ⅠⅡ两个实验,实验操作、现象、结论如下表所示:
| 序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯水与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯水与水反应的产物有具有酸性 |
(3)研究表明,用ClO2气体对自来水消毒效果比用Cl2更好.市售的一种新型消毒剂含两种成分,分别是NaClO3和Na2C2O4.两种成分在溶液中混合便产生ClO2,反应的化学方程式为
考点:性质实验方案的设计,实验装置综合
专题:实验题
分析:(1)浓硫酸密度大于浓盐酸,混合过程会放出大量热,所以分液漏斗中应该盛放浓硫酸;氯化氢与氢氧化钠溶液反应,容易发生倒吸现象;关闭a、b,打开c,稍稍微热丁试管,即可将试管丁中充满;
(2)验证氯气与水反应的产物具有漂白性应首先排除干燥氯气的影响,需要进行对比实验;制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡;
(3)根据题干信息判断反应物为NaClO3和Na2C2O4,生成物为ClO2,根据化合价变化判断另一种产物为Na2CO3,然后写出反应的化学方程式.
(2)验证氯气与水反应的产物具有漂白性应首先排除干燥氯气的影响,需要进行对比实验;制取的氯气中含有HCl气体,HCl溶于水后能与碳酸氢钠粉末反应产生气泡;
(3)根据题干信息判断反应物为NaClO3和Na2C2O4,生成物为ClO2,根据化合价变化判断另一种产物为Na2CO3,然后写出反应的化学方程式.
解答:
解:(1)浓硫酸密度大于浓盐酸,应该将浓硫酸加入浓盐酸中,所以分液漏斗中应该盛放浓硫酸;完全吸收装置中将导管直接插入氢氧化钠溶液中,容易发生倒吸现象;将使烧杯中的水进人试管丁的操作方法为:关闭分液漏斗活塞,夹紧止水夹a、b,打开止水夹c,微热试管丁,使试管中的气体逸出接触烧杯中的水,
故答案为:浓硫酸;用NaOH溶液吸收氯化氢易发生倒吸;关闭分液漏斗活塞,夹紧止水夹a、b,打开止水夹c,微热试管丁,使试管中的气体逸出接触烧杯中的水;
(2)没有事先证明干燥的氯气无漂白性,则不能证明氯气与水反应的产物是否具有漂白性,
浓盐酸易挥发,制取的氯气中含HCl能与NaHCO3反应产生气体,如要证明氯气与水反应的产物具有酸性,必须先除去HCl,可通入饱和食盐水除杂,
故答案为:不合理;没有实验证明干燥的氯气无漂白性;不合理;制取的氯气中含有HCl,HCl溶于水后能与碳酸氢钠反应产生气泡;
(3)NaClO3和Na2C2O4发生氧化还原反应生成ClO2,氯元素的化合价降低,则Na2C2O4中+3价的C元素的化合价只能升高,所以氧化产物为碳酸钠,反应的化学方程式为:2NaClO3+Na2C2O4=2ClO2↑+2Na2CO3,
故答案为:2NaClO3+Na2C2O4=2ClO2↑+2Na2CO3.
故答案为:浓硫酸;用NaOH溶液吸收氯化氢易发生倒吸;关闭分液漏斗活塞,夹紧止水夹a、b,打开止水夹c,微热试管丁,使试管中的气体逸出接触烧杯中的水;
(2)没有事先证明干燥的氯气无漂白性,则不能证明氯气与水反应的产物是否具有漂白性,
浓盐酸易挥发,制取的氯气中含HCl能与NaHCO3反应产生气体,如要证明氯气与水反应的产物具有酸性,必须先除去HCl,可通入饱和食盐水除杂,
故答案为:不合理;没有实验证明干燥的氯气无漂白性;不合理;制取的氯气中含有HCl,HCl溶于水后能与碳酸氢钠反应产生气泡;
(3)NaClO3和Na2C2O4发生氧化还原反应生成ClO2,氯元素的化合价降低,则Na2C2O4中+3价的C元素的化合价只能升高,所以氧化产物为碳酸钠,反应的化学方程式为:2NaClO3+Na2C2O4=2ClO2↑+2Na2CO3,
故答案为:2NaClO3+Na2C2O4=2ClO2↑+2Na2CO3.
点评:本题考查性质实验方案的设计与评价,题目难度中等,侧重考查学生分析和解决问题的能力,注意掌握常见物质的性质实验方案设计与评价的方法,易错点为(2),注意氯气、HClO的性质的异同.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、常温下,某难溶物的Ksp为2.5×105 | ||||
| B、反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | ||||
C、NH3?H2O溶液加水稀释后,溶液中
| ||||
| D、常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
在甲、乙两个密闭容器中,发生如下反应:2A(g)?B(g)+2C(s);△H=mkJ?mol-1.有如图两种图象.下列叙述正确的是( )


| A、若甲为恒容体系,图象(Ⅰ)代表温度不同时,时间与B的体积分数关系图,则m>0 |
| B、恒温条件下,图象 (Ⅰ)可能代表压强不同时,时间与B的体积分数关系图 |
| C、恒温条件下,若甲、乙两容器体积相同,起始时分别向甲中充入2molA,乙中充入1molB、3molC,则达到平衡后两容器中B的体积分数一定不同 |
| D、恒温条件下,乙容器存在图象 (Ⅱ)的关系,则当x代表压强时,y可代表B的体积分数 |
下列各组物质中分子数一定相同的是( )
| A、11.2LH2和0.5molCO2 |
| B、18mLH2O(4℃)和2ⅹ105Pa,27℃32gO2 |
| C、1molCO和88gCO2 |
| D、27℃,22.4LCl2和含4mol氧原子的H2SO4 |
向硝酸钠溶液中加入铜粉不发生反应,若加入某种盐,铜粉可以逐渐溶解,则不符合此条件的是( )
| A、FeCl3 |
| B、NaHSO4 |
| C、FeSO4 |
| D、AgNO3 |