题目内容
往100mL物质的量浓度为1mol/L 的AlCl3 溶液滴入100mL 1mol/L的NaOH溶液
(1)求生成沉淀的质量?
(2)若加入NaOH溶液为350mL,则生成沉淀质量为多少克?
(3)当加入多少毫升1mol/L的NaOH溶液,生成的沉淀恰好完全消失?
(1)求生成沉淀的质量?
(2)若加入NaOH溶液为350mL,则生成沉淀质量为多少克?
(3)当加入多少毫升1mol/L的NaOH溶液,生成的沉淀恰好完全消失?
考点:化学方程式的有关计算
专题:计算题
分析:(1)根据Al3++3OH-═Al(OH)3↓判断碱是否过量,若过量则氢氧化铝会溶解,不过量按照氢氧化钠的物质的量计算;
(2)若加入NaOH溶液为350mL,先发生Al3++3OH-═Al(OH)3↓,又发生Al(OH)3+OH-═AlO2-+2H2O,根据方程式计算;
(3)生成的沉淀恰好完全消失,溶液中发生的总反应为Al3++4OH-═AlO2-+2H2O,根据方程式计算.
(2)若加入NaOH溶液为350mL,先发生Al3++3OH-═Al(OH)3↓,又发生Al(OH)3+OH-═AlO2-+2H2O,根据方程式计算;
(3)生成的沉淀恰好完全消失,溶液中发生的总反应为Al3++4OH-═AlO2-+2H2O,根据方程式计算.
解答:
解:(1)往100mL物质的量浓度为1mol/L 的AlCl3 溶液滴入100mL 1mol/L的NaOH溶液,先发生Al3++3OH-═Al(OH)3↓,由于氢氧化钠的物质的量为0.1mol,氢氧化钠不足,则生成的氢氧化铝为m=0.1mol×
×78g/mol=2.6g;
答:生成沉淀的质量为2.6g;
(2)若加入NaOH溶液为350mL,先发生Al3++3OH-═Al(OH)3↓,
0.1mol 0.3mol 0.1mol
又发生Al(OH)3+OH-═AlO2-+2H2O,
0.05mol 0.05mol
所以剩余的氢氧化铝为0.1mol-0.05mol=0.05mol,其质量为0.05mol×78g/mol=3.9g;
答:若加入NaOH溶液为350mL,则生成沉淀质量为3.9g;
(3)生成的沉淀恰好完全消失,溶液中发生的总反应为Al3++4OH-═AlO2-+2H2O,
则消耗的氢氧化钠为n(NaOH)=4n(AlCl3)=0.4mol,所以V=
=
=0.4L=400ml;
答:当加入400ml1mol/L的NaOH溶液,生成的沉淀恰好完全消失.
| 1 |
| 3 |
答:生成沉淀的质量为2.6g;
(2)若加入NaOH溶液为350mL,先发生Al3++3OH-═Al(OH)3↓,
0.1mol 0.3mol 0.1mol
又发生Al(OH)3+OH-═AlO2-+2H2O,
0.05mol 0.05mol
所以剩余的氢氧化铝为0.1mol-0.05mol=0.05mol,其质量为0.05mol×78g/mol=3.9g;
答:若加入NaOH溶液为350mL,则生成沉淀质量为3.9g;
(3)生成的沉淀恰好完全消失,溶液中发生的总反应为Al3++4OH-═AlO2-+2H2O,
则消耗的氢氧化钠为n(NaOH)=4n(AlCl3)=0.4mol,所以V=
| n |
| c |
| 0.4mol |
| 1mol/L |
答:当加入400ml1mol/L的NaOH溶液,生成的沉淀恰好完全消失.
点评:本题考查方程式的有关计算,题目难度中等,明确发生的反应是解题的关键,根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算.

练习册系列答案
相关题目
下列溶液中Cl-的物质的量浓度与l00mL,1mol/L MgCl2溶液中Cl-的物质的量浓度相同的是( )
| A、50mL 2mol/LCaCl2溶液 |
| B、100mL 2mol/LNaCl溶液 |
| C、50mL 4mol/LCaCl2溶液 |
| D、100mL 1mol/LNaCl溶液 |
现有W、X、Y、Z四种物质,它们能发生置换反应:W+X→Y+Z,则Z不可能是( )
| A、Fe3O4 |
| B、NaOH |
| C、Fe(OH)3 |
| D、Si |
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质的一种或两种,现将13.8g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液得到9克沉淀,对样品所含杂质的正确判断是( )
| A、肯定没有KNO3 |
| B、肯定没有Ba(NO3)2和KNO3 |
| C、肯定没有Ba(NO3)2,可能有Na2CO3 |
| D、肯定没有Ba(NO3)2,可能有KNO3 |
下列各组离子,能在溶液中大量共存的是( )
| A、H+、K+、OH- |
| B、H+、Cl-、CO32- |
| C、Ba+、Na+、SO42- |
| D、Na+、Cu2+、Cl- |
有NaCl、FeCl3、CuCl2、CaCO3,能区分他们的最简单的试剂是( )
| A、盐酸 | B、水 |
| C、氢氧化钠溶液 | D、酒精 |

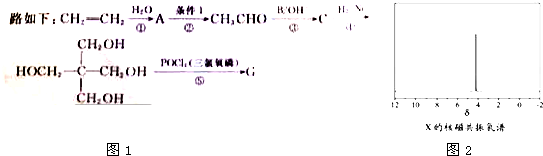
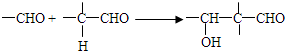
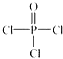 )与
)与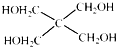 以物质的量之比2:1反应时,生成G,并释放出一种酸性气体,G的核磁共振氢谱如图2所示.
以物质的量之比2:1反应时,生成G,并释放出一种酸性气体,G的核磁共振氢谱如图2所示.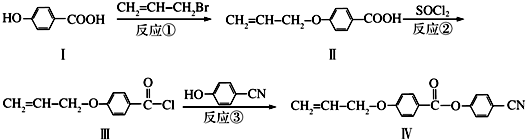
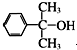 也可与Ⅲ发生类似反应③的反应生成有机物V.V的结构简式是
也可与Ⅲ发生类似反应③的反应生成有机物V.V的结构简式是