题目内容
5.在一密闭容器中发生反应A2(g)+3B2(g)?2AB3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示: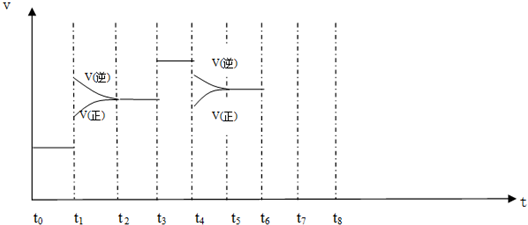
回答下列问题:
(1)处于平衡状态的时间段是ACDF(填选项).
A.t0-t1B.t1-t2C.t2-t3 D.t3-t4 E.t4-t5F.t5-t6
(2)t1、t3、t4时刻分别改变的一个条件是填选项).
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻C;t3时刻E;t4时刻B.
(3)如果在t6时刻,从反应体系中分离出部分AB3,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线.
(4)依据(2)中的结论,下列时间段中,AB3的百分含量最高的是A(填选项).
A.t0-t1 B.t2-t3 C.t3-t4 D.t5-t6
(5)一定条件下,合成AB3反应达到平衡时,测得混合气体中AB3的体积分数为20%,则反应后与反应前的混合气体体积之比为5:6.
分析 (1)由图可知,正逆反应相等时,为化学平衡状态;
(2)A2(g)+3B2(g)?2AB3(g)△H<0,为气体体积减小且放热的反应,结合t1时速率均增大且逆反应速率大于正反应速率,t3时正逆反应速率相等,t4时速率均减小且逆反应速率大于正反应速率分析;
(3)在t6时刻,从反应体系中分离出部分AB3,t7时刻反应达到平衡状态,则瞬间正反应速率不变,逆反应速率减小,平衡正向移动;
(4)结合反应特点可知,t0-t1为原平衡状态,t2-t3时平衡逆向移动达到平衡状态,t3-t4时平衡不移动,t5-t6时平衡逆向移动达到平衡状态;
(5)合成AB3反应达到平衡时,测得混合气体中AB3的体积分数为20%,结合反应及体积差计算.
解答 解:(1)由图可知,正逆反应相等时,为化学平衡状态,则ACDF,故答案为:ACDF;
(2)A2(g)+3B2(g)?2AB3(g)△H<0,为气体体积减小且放热的反应,结合t1时速率均增大且逆反应速率大于正反应速率,t3时正逆反应速率相等,t4时速率均减小且逆反应速率大于正反应速率,则改变的条件分别为C、E、B,故答案为:C;E;B;
(3)在t6时刻,从反应体系中分离出部分AB3,t7时刻反应达到平衡状态,则瞬间正反应速率不变,逆反应速率减小,平衡正向移动,则图中画出反应速率的变化曲线为 ,
,
故答案为: ;
;
(4)结合反应特点可知,t0-t1为原平衡状态,t2-t3时平衡逆向移动达到平衡状态,t3-t4时平衡不移动,t5-t6时平衡逆向移动达到平衡状态,则原平衡状态时AB3的百分含量最高,故答案为:A;
(5)合成AB3反应达到平衡时,测得混合气体中AB3的体积分数为20%,设平衡后体积为100L,则
A2(g)+3B2(g)?2AB3(g)△n
1 3 2 2
20L 20L
则原混合气体的体积为100L+20L=120L,
则反应后与反应前的混合气体体积之比为100L:120L=5:6,
故答案为:5:6.
点评 本题考查化学反应速率及化学平衡,为高频考点,把握速率的影响因素、平衡移动及图象分析为解答的关键,侧重分析与应用能力的考查,题目难度不大.

| A. | 一氯甲烷的结构式CH3Cl | B. | 丁烷的结构简式CH3(CH2)2CH3 | ||
| C. | 氯化铵的电子式 | D. | 苯的分子式 |
| A. | 将混有HCl的Cl2通入盛有饱和NaHCO3溶液的洗气瓶除去 | |
| B. | 实验室制取Cl2,浓盐酸起到酸性和还原剂的作用 | |
| C. | 用惰性电极电解饱和食盐水的离子方程式为2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| D. | 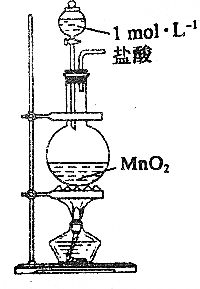 实验室可用图所示装置于制取少量Cl2 |
| A. | 工业上用电解熔融氧化物的方法制备C单质 | |
| B. | 离子半径:C>D | |
| C. | 熔融它们的单质,所克服的微粒间作用力都相同 | |
| D. | 含D的盐溶液都显酸性 |
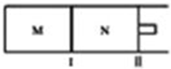 如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)?xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )| A. | 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) | |
| B. | 若x<3,C的平衡浓度关系为:c(M)<c(N) | |
| C. | 若x>3,达到平衡后B的转化率关系为:α(M)>α(N) | |
| D. | x不论为何值,平衡时M、N中的平均相对分子质量都相等 |
| A. | NH4Cl的电子式: | |
| B. | HClO的结构式为:H-Cl-O | |
| C. | 氯化镁的电子式: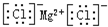 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
| A. | 2H2+O2═2H2O△H=-571.6 kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g )△H=-285.8kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ/mol |
| A. | CuCl2[CuSO4] | B. | NaCl[HCl] | C. | NaOH[Na2O] | D. | CuSO4[Cu(OH)2] |
