题目内容
1.将一块光洁的铁片放入100mL某浓度的硝酸中,当反应不再有气体放出时,取出铁片洗净晾干称重,发现铁片质量减少了4.2g.则该硝酸的浓为( )| A. | 1.5mol/L | B. | 3.0mol/L | C. | 2.0mol/L | D. | 无法计算 |
分析 Fe有剩余,反应生成Fe(NO3)2,参加反应反应Fe为4.2g,由于Fe在浓硝酸中发生钝化,故应是Fe与稀硝酸反应生成NO,根据电子转移守恒计算NO物质的量,再根据氮原子守恒计算硝酸物质的量,进而计算硝酸的浓度.
解答 解:Fe有剩余,反应生成Fe(NO3)2,参加反应反应Fe为4.2g,参加反应Fe为$\frac{4.2g}{56g/mol}$=0.075mol,由于Fe在浓硝酸中发生钝化,故应是Fe与稀硝酸反应生成NO,根据电子转移守恒,生成NO为$\frac{0.075mol×2}{3}$=0.05mol,根据N原子守恒,则n(HNO3)=2n[Fe(NO3)2]+n(NO)=2×0.075mol+0.05mol=0.2mol,故该硝酸的浓度为$\frac{0.2mol}{0.1L}$=2mol/L,
故选:C.
点评 本题考查化学方程式计算、硝酸的性质,属于易错题目,学生容易忽略Fe在浓硝酸中发生钝化,认为生成的气体不能确定,而认为题目无法计算.

练习册系列答案
相关题目
11.下列溶液中各微粒的浓度关系正确的是( )
| A. | NH4Cl溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | Na2SO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| C. | NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | 等体积、等物质的量浓度的CH3COONa和弱酸CH3COOH混合后的溶液中:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) |
12.下列有关物质性质的应用正确的是( )
| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 氯化铝是一种电解质,可用于电解制铝 |
9.化学与新型材料、环境保护、能源开发等密切相关.下列说法正确的是( )
| A. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| B. | 推广燃煤发电,停建核电站,以防核泄漏事故发生 | |
| C. | 设计绿色化工工艺,提高反应的选择性和原子利用率 | |
| D. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 |
16.某化学兴趣小组的同学利用如图所示的实验装置进行实验(图中a、b、c表示止水夹).

请按要求填空:
(1)已知实验室制取少量的乙烯时,常利用乙醇和浓硫酸快速加热到170℃来制取,发生反应的化学方程式如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.此实验过程中常因温度过高而发生副反应,有部分乙醇和浓H2SO4反应生成SO2、CO2、水蒸气和炭黑.若实验室选用A、C、E相连后的装置制备乙烯并检验生成的气体,且E中盛放酸性高锰酸钾溶液或溴水,则丙种必须盛放的一种试剂为氢氧化钠溶液.若实验室选用A、E相连后的装置制备乙烯并检验生成的气体,则E中盛放的试剂为溴水.有同学认为,如果在A装置上再加一种仪器,就可以减少副反应的发生,则该仪器为温度计.
(2)A、C、E(E中盛有氢氧化钠溶液)相连后的装置也可用于制取Cl2并进行相关的性质实验.
①写出A装置中发生反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
②若在丙中加入适量水,即可制得氯水.将所得的氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
请你评价实验Ⅰ、Ⅱ的结论是否合理?实验Ⅰ结论不合理,实验Ⅱ结论不合理;若不合理,请说明理由:实验Ⅰ结论不合理,氯气和次氯酸两种物质都能使碘离子生成碘单质,从而无法确定哪种物质使溶液变蓝;实验Ⅱ结论不合理,溶液中 的氯离子可能是挥发出来的氯化氢产生的.
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.
①B中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
②欲用D装置验证NO2与水的反应,请写出操作步骤关闭止水夹 ab,再打开止水夹 c,双手紧握(或微热)试管丁使试管中气体逸出,二氧化氮与水接触后即可引发烧杯中的水倒流到试管丁中.

请按要求填空:
(1)已知实验室制取少量的乙烯时,常利用乙醇和浓硫酸快速加热到170℃来制取,发生反应的化学方程式如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.此实验过程中常因温度过高而发生副反应,有部分乙醇和浓H2SO4反应生成SO2、CO2、水蒸气和炭黑.若实验室选用A、C、E相连后的装置制备乙烯并检验生成的气体,且E中盛放酸性高锰酸钾溶液或溴水,则丙种必须盛放的一种试剂为氢氧化钠溶液.若实验室选用A、E相连后的装置制备乙烯并检验生成的气体,则E中盛放的试剂为溴水.有同学认为,如果在A装置上再加一种仪器,就可以减少副反应的发生,则该仪器为温度计.
(2)A、C、E(E中盛有氢氧化钠溶液)相连后的装置也可用于制取Cl2并进行相关的性质实验.
①写出A装置中发生反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
②若在丙中加入适量水,即可制得氯水.将所得的氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 向氯水中加入淀粉KI溶液 | 溶液变蓝 | 氯水中含有氯气分子 |
| Ⅱ | 将氯水滴入AgNO3溶液 | 产生白色沉淀 | 氯气与水反应的产物中含有Cl- |
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验.
①B中发生反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O.
②欲用D装置验证NO2与水的反应,请写出操作步骤关闭止水夹 ab,再打开止水夹 c,双手紧握(或微热)试管丁使试管中气体逸出,二氧化氮与水接触后即可引发烧杯中的水倒流到试管丁中.
6.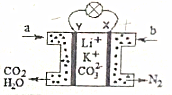 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH3OH为燃料时,该电池工作原理如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH3OH为燃料时,该电池工作原理如图.下列说法正确的是( )
 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH3OH为燃料时,该电池工作原理如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH3OH为燃料时,该电池工作原理如图.下列说法正确的是( )| A. | b为空气,电子由X极经导线流向Y极 | |
| B. | 在熔融电解质中,CO32-向X极移动 | |
| C. | 消耗1molCH3OH,消耗氧气分子数目约为3×6.02×1023 | |
| D. | 正极反应式为:O2+2CO2+4e-═2CO32- |
15.经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
(1)c(H+)=0.01mol/L.
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4•7H2O).
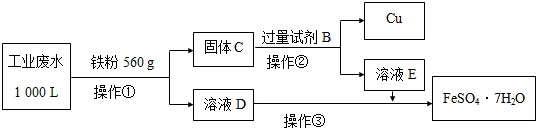
①工业废水中加入铁粉后,反应的离子方程式为:Fe+Cu2+═Fe2++Cu、Fe+2Fe3+═3Fe2+、Fe+2H+═Fe2++H2↑.
②试剂B是H2SO4.
③操作③是蒸发浓缩、冷却结晶、过滤,最后用少量冷水洗涤晶体,在低温下干燥.
④通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽.
⑤获得的FeSO4•7H2O需密闭保存,原因是FeSO4有还原性,易被氧化(或FeSO4•7H2O失去结晶水).
⑥上述1000L废水经处理,可获得 FeSO4•7H2O的物质的量是12mol.
| 离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
| 浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4•7H2O).

①工业废水中加入铁粉后,反应的离子方程式为:Fe+Cu2+═Fe2++Cu、Fe+2Fe3+═3Fe2+、Fe+2H+═Fe2++H2↑.
②试剂B是H2SO4.
③操作③是蒸发浓缩、冷却结晶、过滤,最后用少量冷水洗涤晶体,在低温下干燥.
④通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽.
⑤获得的FeSO4•7H2O需密闭保存,原因是FeSO4有还原性,易被氧化(或FeSO4•7H2O失去结晶水).
⑥上述1000L废水经处理,可获得 FeSO4•7H2O的物质的量是12mol.
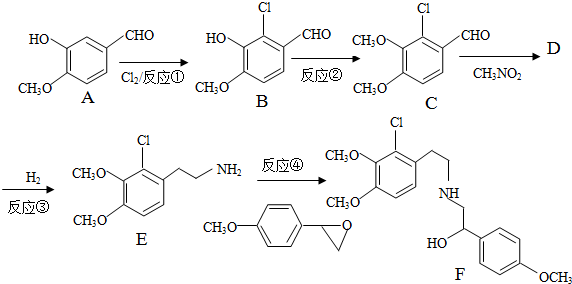
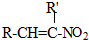 +H2O
+H2O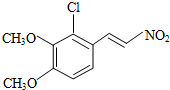 ,反应③中1摩尔D需要4摩尔H2才能转化为E
,反应③中1摩尔D需要4摩尔H2才能转化为E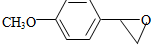 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式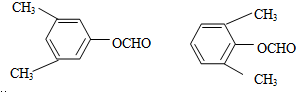 .
.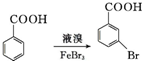 .写出以
.写出以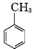 为原料制备
为原料制备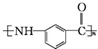 的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)