题目内容
15.用NA表示阿伏伽德罗常数的值.下列说法正确的是( )| A. | 1mol乙基(-CH2CH3)中含有共价键的总数为7NA | |
| B. | 1L 0.1mol/L盐酸溶液所含HCl的分子数为NA | |
| C. | 标准状况下,11.2L NO2气体中含有的分子数为0.5NA | |
| D. | 标况下11.2L CO和CO2混合气体中,所含碳原子数为0.5NA |
分析 A、乙基中含6条共价键;
B、HCl溶于水后共价键被破坏;
C、分子个数N=$\frac{V}{Vm}{N}_{A}$;
D、求出混合物的物质的量,然后根据CO和二氧化碳中均含一个碳原子来分析.
解答 解:A、乙基中含6条共价键,故1mol乙基中含6NA条共价键,故A错误;
B、HCl溶于水后共价键被破坏,完全电离为氢离子和氯离子,故盐酸溶液中无HCl分子,故B错误;
C、标况下11.2L二氧化氮气体中的分子个数N=$\frac{V}{Vm}{N}_{A}$=$\frac{11.2L}{22.4L/mol}×{N}_{A}/mol$=0.5NA,故C正确;
D、标况下11.2L混合物的物质的量为0.5mol,而CO和二氧化碳中均含一个碳原子,故0.5mol混合物中含0.5NA个碳原子,与CO和二氧化碳的比例无关,故D正确.
故选CD.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
5.用NA表示阿伏伽德罗常数的值.下列说法中,正确的是( )
| A. | 通常状况下,1molCCl4含有的分子数为NA个 | |
| B. | 0.5mol/LNH4Cl溶液中NH4+的数目小于0.2NA个 | |
| C. | 16.0gCuS和CuO的混合物中含有的铜原子数为0.3NA | |
| D. | 向FeI2溶液中通过适量氯气,当有1molFe2+被氧化时,总共转移电子的数目为NA个 |
12.将铜丝插入浓硫硫加热取出后,在铜丝表面会产生一层黑色固体甲,为研究固体甲的成分,进行下实验.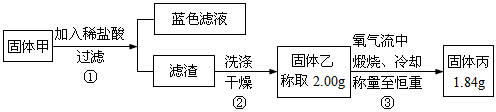
已知,氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,Cu在氧气流中锻烧,可以转化为氧化铜.硫化铜和硫化亚铜常温下都不溶于稀盐,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.
下列用关说法正确的是( )

已知,氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,Cu在氧气流中锻烧,可以转化为氧化铜.硫化铜和硫化亚铜常温下都不溶于稀盐,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.
下列用关说法正确的是( )
| A. | 加盐酸有蓝色溶液生成,说明固体甲中一定含有氧化铜 | |
| B. | 步骤①所得滤渣中肯定含有单质铜 | |
| C. | 固体甲中若存在Cu2O,也可能有Cu2S | |
| D. | 固体甲中,CuS和Cu2S不能同时存在 |
9.在核反应方程24He+714N→817O+X中,X代表的粒子是( )
| A. | 11H | B. | 12H | C. | -10e | D. | 01n |
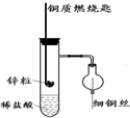 如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.
如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.