题目内容
12.下列说法正确的是( )| A. | 在体积可变的密闭容器中发生可逆反应 A(g)+B(g)?C(g)+D(g),当混合气体的密度不再改变时,说明反应已达到化学平衡状态 | |
| B. | 对于反应 C(s)+CO2(g)?2CO(g)△H>0,改变某一条件,若化学平衡常数增大,则反应速率可能减小 | |
| C. | 向 0.1 mol•L-1的氨水中加入氯化铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}0)}$增大 | |
| D. | 常温下,向 Mg(OH)2悬浊液中加入 MgCl2浓溶液后,溶液中$\frac{c(M{g}^{2+})•c(O{H}^{-})}{c({H}^{+})}$不变(一定温度下,Mg(OH)2悬浊液中 c(Mg2+)﹒c2(OH-)为定值) |
分析 A、混合气体的密度等于混合气体的质量和体积的比值,据此回答判断;
B、吸热反应,升高温度,化学平衡常数增大,升高温度,化学反应速率增加;
C、NH3•H2O电离常数只受温度影响,温度不变Kb不变,加入氯化铵固体,溶液中c(NH4+)增大.
D、溶液中存在氢氧化镁的溶解平衡,水的电离平衡,氢氧化镁Ksp=c(Mg2+)•c2(OH-),在一定温度下为常数,水的离子积Kw=c(H+)•c(OH-),一定稳定性Kw为常数,溶液中溶液中$\frac{c(M{g}^{2+})c(O{H}^{-})}{c({H}^{+})}$=$\frac{Ksp}{Kw}$,据此回答.
解答 解:A、体积可变的密闭容器中,气体质量始终不变,所以混合气体的密度变化,密度不再改变时,说明已达到化学平衡状态,故A正确;
B、影响化学平衡的因素是温度,该反应正反应是吸热反应,平衡常数增大说明温度升高,升高温度反应速率增大,故B错误;
C、NH3•H2O电离常数只受温度影响,温度不变Kb不变,加入氯化铵固体,溶液中c(NH4+)增大,则溶液Kb和铵根离子浓度比值减小,氢氧根离子和氨水浓度之比等于Kb和铵根离子浓度比值,故C错误;
D、溶液中存在氢氧化镁的溶解平衡,水的电离平衡,氢氧化镁Ksp=c(Mg2+)•c2(OH-),在一定温度下为常数,水的离子积Kw=c(H+)•c(OH-),一定温度下Kw为常数,溶液中溶液中$\frac{c(M{g}^{2+})c(O{H}^{-})}{c({H}^{+})}$=$\frac{Ksp}{Kw}$,不发生变化,故D正确.
故选:AD.
点评 本题考查平衡状态判断、平衡常数的运用、平衡常数的影响因素等,难度中等,注意平衡常数的书写与影响因素.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
2.在浅绿色的Fe(NO3)2溶液中存在如下平衡:Fe2++2H2O?Fe(OH)2+2H+,若向该溶液中滴加足量的盐酸,则溶液的颜色( )
| A. | 绿色更浅 | B. | 绿色更深 | C. | 变黄 | D. | 无变化 |
20.某化学研究小组在使用FeSO4溶液与NaOH溶液制备Fe(OH)2沉淀过程中观察到生成的白色沉淀迅速转变为灰绿色,最后变为红褐色,该小组针对绿色物质展开研究.
[查阅文献]
(1)写出Fe(OH)2在空气中被氧化为Fe(OH)3的化学方程式6Fe(OH)2+O2+2H2O═2Fe3(OH)8;
[提出假设]假设一:绿色物质是Fe(OH)2•nH2O;
假设二:绿色物质是Fe3(OH)8;
…
[实验探究]针对上述假设与假设二,展开实验研究:
(1)实验室保存FeSO4溶液常需加入Fe、H2SO4(填化学式,下同),为检验某FeSO4溶液是否变质,可向溶液中加入KSCN溶液或NaOH;
(2)由实验一与实验三(填实验序号)的现象可推断假设一可能成立.
(3)为了进一步探究假设二是否成立,小组成员进行如下实验,请完成下表:
试剂:蒸馏水、NaOH溶液、苯、FeSO4溶液、氧气
[查阅文献]
| 文献名称 | 有关Fe(OH)2的描述 |
| 《大学普通化学(下册)》 | 白色沉淀,易被氧化成微绿色Fe3(OH)8 |
| 《化学教育》 | 白色沉淀,在冷水中易形成绿色的水合物Fe(OH)2•nH2O,热水中不易形成水合物 |
[提出假设]假设一:绿色物质是Fe(OH)2•nH2O;
假设二:绿色物质是Fe3(OH)8;
…
[实验探究]针对上述假设与假设二,展开实验研究:
| 实验序号 | 实验步骤 | 实验现象 |
| 一 | ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②保持较高温度,使用长滴管伸入液面下依次挤入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色絮状沉淀,并能保持一段时间 |
| 二 | ①在试管中加入20mL蒸馏水 ②加入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色沉淀,迅速转变为灰绿色,最后变为红褐色 |
| 三 | ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②恢复室温后,使用长滴管伸入液面下依次挤入一滴饱和FeSO4溶液、一滴NaOH溶液 | 出现白色沉淀,迅速转变为绿色沉淀 |
(2)由实验一与实验三(填实验序号)的现象可推断假设一可能成立.
(3)为了进一步探究假设二是否成立,小组成员进行如下实验,请完成下表:
试剂:蒸馏水、NaOH溶液、苯、FeSO4溶液、氧气
| 实验步骤 | 实验现象与结论 |
| ①在试管中加入20mL蒸馏水,加热煮沸,滴苯液封 ②迅速用长滴管伸入液面下依次挤入一滴饱和FeSO4 溶液、一滴NaOH溶液 ③将O2缓缓通入白色沉淀中. | 若沉淀中出现绿色的迹象,则假设二成立; 若沉淀中没有出现任何绿色的迹象,则假设二不成立. |
7.三氯化碘(ICl3,I的化合价为+3价)在药物合成中用途广泛,其熔点:33℃,沸点:73℃,实验室可用如图装置制取ICl3.
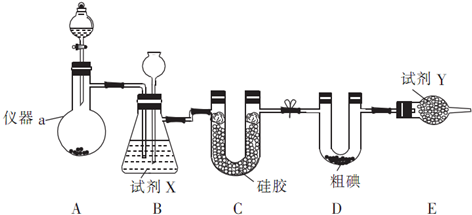
(1)制备氯气选用的药品为漂白精固体(主要成分为Ca(ClO)2)和浓盐酸,相关反应的化学方程式为:
Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;试剂X为饱和食盐水、Y为碱石灰;
(2)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象瓶中液面下降,长颈漏斗中液面上升;
(3)某同学欲测定ICl3样品中ICl3的纯度,他准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI晶体,充分反应:ICl3+3KI═2I2+3KCl(样品中杂质不反应).将所得溶液配置成100mL待测液.取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2S2O32-═2I-+S4O62-),以淀粉溶液作指示剂,达到终点时的现象为当加入最后一滴标准液时,溶液由蓝色变为无色,且半分钟内不恢复蓝色;重复滴定,实验数据记录如下:
该样品中ICl3的质量分数为93.4%(ICl3相对分子质量为233.5)

(1)制备氯气选用的药品为漂白精固体(主要成分为Ca(ClO)2)和浓盐酸,相关反应的化学方程式为:
Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;试剂X为饱和食盐水、Y为碱石灰;
(2)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象瓶中液面下降,长颈漏斗中液面上升;
(3)某同学欲测定ICl3样品中ICl3的纯度,他准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI晶体,充分反应:ICl3+3KI═2I2+3KCl(样品中杂质不反应).将所得溶液配置成100mL待测液.取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2S2O32-═2I-+S4O62-),以淀粉溶液作指示剂,达到终点时的现象为当加入最后一滴标准液时,溶液由蓝色变为无色,且半分钟内不恢复蓝色;重复滴定,实验数据记录如下:
| 滴定次数 | 待测液体积/mL | Na2S2O3标准液体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
| 第三次 | 25.00 | 4.20 | 26.70 |
4.下列说法中不正确的是( )
①由同一种元素组成的物质一定是单质
②阴离子一定不含金属元素,阳离子一定含金属元素
③碱性氧化物一定是金属氧化物
④酸性氧化物一定是非金属氧化物
⑤按酸分子中电离出的氢离子数目不同,可将酸分为一元酸、二元酸和多元酸
⑥无氧酸一定是非金属的氢化物.
①由同一种元素组成的物质一定是单质
②阴离子一定不含金属元素,阳离子一定含金属元素
③碱性氧化物一定是金属氧化物
④酸性氧化物一定是非金属氧化物
⑤按酸分子中电离出的氢离子数目不同,可将酸分为一元酸、二元酸和多元酸
⑥无氧酸一定是非金属的氢化物.
| A. | ①③④⑤ | B. | ①②④⑥ | C. | ①②③⑥ | D. | ②③⑤⑥ |
1.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
(1)2Fe2++H2O2+2H+═2Fe3++2H2O (2)2Fe3++H2O2═2Fe2++O2↑+2H+
下列说法不正确的是( )
(1)2Fe2++H2O2+2H+═2Fe3++2H2O (2)2Fe3++H2O2═2Fe2++O2↑+2H+
下列说法不正确的是( )
| A. | (1)中H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 | |
| B. | 在反应过程中,溶液的H+浓度不变 | |
| C. | 在反应过程中,Fe2+和Fe3+的总量保持不变 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
6.实验室测定酸碱反应的反应热时,不需要用到的玻璃仪器是( )
| A. | 试管 | B. | 温度计 | C. | 烧杯 | D. | 环型玻璃搅拌棒 |


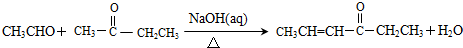
 ,其反应类型是加成反应.
,其反应类型是加成反应.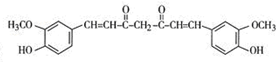 .
.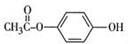 .
. A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、H2SO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、H2SO4中的一种.常温下进行下列实验: