题目内容
1.如表是元素周期表主族元素的一部分.短周期元素Y的最外层电子数是最内层电子数的2倍,Z单质可在空气中燃烧.下列叙述错误的是( )| X | |||
| Y | Z | W |
| A. | Z的最高价氧化物的水化物是强酸 | |
| B. | Y的最高价氧化物能溶于烧碱溶液 | |
| C. | X与W形成的化合物中含有离子键 | |
| D. | Z、W分别形成的简单离子中,前者的半径较大 |
分析 短周期元素Y的最外层电子数是最内层电子数的2倍,则由位置可知,Y位于第三周期,3个电子层的电子分别为2、8、4,即Y为Si,Z单质可在空气中燃烧,结合位置可知,X为C,Z为S,W为Cl,然后结合元素周期律及元素化合物知识来解答.
解答 解:短周期元素Y的最外层电子数是最内层电子数的2倍,则由位置可知,Y位于第三周期,3个电子层的电子分别为2、8、4,即Y为Si,Z单质可在空气中燃烧,结合位置可知,X为C,Z为S,W为Cl,
A.Z的最高价氧化物的水化物硫酸是强酸,故A正确;
B.Y的最高价氧化物为二氧化硅,能溶于烧碱溶液,反应生成硅酸钠和水,故B正确;
C.X与W形成的化合物为CCl4,含有C-Cl共价键,故C错误;
D.Z、W分别形成的简单离子,具有相同电子层结构,原子序数大的离子半径小,则前者的半径较大,故D正确;
故选C.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意Y为元素推断的突破口,题目难度不大.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
12.X、Y、Z、W为四种短周期主族元素,已知原子序数Y>Z>W>X.其中X、Z同主族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6.下列说法正确的是( )
| A. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 | |
| B. | Y元素最高价氧化物对应的水化物化学式为H2YO4 | |
| C. | 原子半径由大到小的顺序为Z>Y>W | |
| D. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
13.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向AgCl悬浊液中加入NaI溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| C | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| D | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| A. | A | B. | B | C. | C | D. | D |
10.化学在生产和日常生活中有着重要的应用.下列叙述正确的是( )
| A. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾 | |
| D. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
17.下列关于电解质溶液的叙述正确的是( )
| A. | 常温下,相同浓度的盐酸与氨水的混合溶液的pH=7,消耗盐酸的体积大 | |
| B. | 将pH=5的醋酸溶液稀释1000倍,溶液的pH=8 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
6.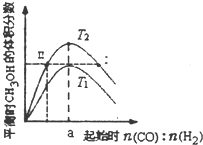 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)△H<0达到平衡,平衡时CH3OH的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )| A. | 由图象可推知,反应温度T2>T1 | |
| B. | 同一温度,增大压强,平衡右移,平衡常数K增大 | |
| C. | 同一温度,当a=0.5时,CO转化率最高 | |
| D. | 对于状态I和II,若再向体系中充入He,重新达到平衡后,二者的平衡体系中CH3OH的浓度相等 |
11.下列物质性质与应用对应关系正确的是( )
| A. | 氧化铝熔点很高,可用于制造耐火坩埚 | |
| B. | 浓硫酸具有脱水性,可用于干燥氢气 | |
| C. | 氢氧化铝能与氢氧化钠反应,可用于治疗胃酸过多 | |
| D. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 |
8.某小组同学用如下装置电解食盐水,并对电解产物进行探究.
资料显示:
(1)经检验,b极产生的气体是H2,b极附近溶液的pH增大(填“增大”、“减小”、或“不变”);铜丝a应与电源的正(填“正”或“负”)极相连.
(2)同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是Cu-e-+Cl-=CuCl↓.
(3)①橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是CuCl+OH-=CuOH+Cl-、2CuOH=Cu2O+H2O(用方程式表示);
②结合离子在溶液中的运动规律,解释“a极附近沉淀自下而上”变为橙黄色原因是通电时,在阴极产生的OH-向阳极定向移动.
(4)同学们通过实验进一步证实沉淀中含有$\stackrel{+1}{Cu}$:将橙黄色沉淀滤出洗涤后,滴加0.2mol/L H2SO4至过量,应观察到的现象是沉淀溶解,溶液变蓝,且有少量红色固体产生.
(5)同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为$\stackrel{+1}{Cu}$.为此,他们用Cu电极电解5mol/L NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀.
根据现象能否得出“该猜想不成立”的结论,并说明理由:不能,阳极产生的大量O2可能将CuOH氧化.
| 实验装置 | 电解质溶液 | 实验现象 | |
 | 5mol/L NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
| ①氯化亚铜(CuCl)为白色粉末,微溶于水; ②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的Cu2O; ③Cu+水溶液中不稳定,酸性条件下易歧化为Cu2+和Cu; ④氢氧化铜可以溶于浓NaOH得到蓝色溶液. |
(2)同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是Cu-e-+Cl-=CuCl↓.
(3)①橙黄色沉淀中含有Cu2O,则CuCl转化为Cu2O的原因是CuCl+OH-=CuOH+Cl-、2CuOH=Cu2O+H2O(用方程式表示);
②结合离子在溶液中的运动规律,解释“a极附近沉淀自下而上”变为橙黄色原因是通电时,在阴极产生的OH-向阳极定向移动.
(4)同学们通过实验进一步证实沉淀中含有$\stackrel{+1}{Cu}$:将橙黄色沉淀滤出洗涤后,滴加0.2mol/L H2SO4至过量,应观察到的现象是沉淀溶解,溶液变蓝,且有少量红色固体产生.
(5)同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为$\stackrel{+1}{Cu}$.为此,他们用Cu电极电解5mol/L NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀.
根据现象能否得出“该猜想不成立”的结论,并说明理由:不能,阳极产生的大量O2可能将CuOH氧化.