题目内容
11.下列物质性质与应用对应关系正确的是( )| A. | 氧化铝熔点很高,可用于制造耐火坩埚 | |
| B. | 浓硫酸具有脱水性,可用于干燥氢气 | |
| C. | 氢氧化铝能与氢氧化钠反应,可用于治疗胃酸过多 | |
| D. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 |
分析 A.Al2O3的熔点高,可作耐火材料;
B.浓硫酸具有吸水性,能够做干燥剂;
C.氢氧化铝能够与酸反应,可以治疗胃酸;
D.二氧化硅具有良好的光学性质,可以制造光导纤维.
解答 解:A.Al2O3的熔点高,可作耐火材料,故A正确;
B.浓硫酸具有吸水性,可用于干燥氯气,故B错误;
C.胃酸中含有的是盐酸,由于氢氧化铝与盐酸反应,可用于治疗胃酸过多,故C错误;
D.SiO2制光导纤维,利用的是其良好的光学性质,不是利用其能与HF反应,故D错误;
故选A.
点评 本题考查了常见物质组成、结构与性质的关系,题目难度中等,明确常见元素及其化合物性质为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
4. 卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:
卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:
(1)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为平面三角形.
(2)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃.MgO晶体的熔点高于NaCl晶体主要原因是MgO晶体中所含离子半径小、电荷数多,晶格能大.其中基态C1-的核外电子排布式为:1s22s22p63s23p6.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
(4)CCl4分子中的C原子和NF3分子中的N原子的杂化方式.如果相同,则其杂化方式为sp3杂化;如果不相同,则其杂化方式分别为不填.写出CCl4的一种等电子体的化学式:SO42-等.
(5)CuCl42-是黄色的,而CuCl2的稀溶液是浅蓝色,说明原因稀溶液中主要形成[Cu(H2O)4]2+配离子.
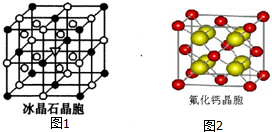
(6)在电解冶炼铝的过程中加入冰晶石(Na3AlF6),可起到降低A12O3熔点的作用.冰晶石由两种微粒构成,冰晶石的晶胞结构如图1甲所示,●位于大立方体的顶点和面心,O位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是Na+(填具体的微粒符号).
(7)已知CaF2晶体(如图2),其中Ca2+的配位数为8.CaF2晶体的密度为ρg•cm-3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$ρNAa3.
 卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:
卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.请回答下列问题:(1)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为平面三角形.
(2)NaCl和MgO都属离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃.MgO晶体的熔点高于NaCl晶体主要原因是MgO晶体中所含离子半径小、电荷数多,晶格能大.其中基态C1-的核外电子排布式为:1s22s22p63s23p6.
(3)请根据如表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是I.
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 | 900 |
(5)CuCl42-是黄色的,而CuCl2的稀溶液是浅蓝色,说明原因稀溶液中主要形成[Cu(H2O)4]2+配离子.
(6)在电解冶炼铝的过程中加入冰晶石(Na3AlF6),可起到降低A12O3熔点的作用.冰晶石由两种微粒构成,冰晶石的晶胞结构如图1甲所示,●位于大立方体的顶点和面心,O位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是Na+(填具体的微粒符号).
(7)已知CaF2晶体(如图2),其中Ca2+的配位数为8.CaF2晶体的密度为ρg•cm-3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为$\frac{\sqrt{2}}{2}$ρNAa3.
5.某溶液中大量存在Ca2+、H+、Cl-,该溶液中还可能大量存在的离子是( )
| A. | Ag+ | B. | CO32- | C. | OH- | D. | Mg2+ |
1.如表是元素周期表主族元素的一部分.短周期元素Y的最外层电子数是最内层电子数的2倍,Z单质可在空气中燃烧.下列叙述错误的是( )
| X | |||
| Y | Z | W |
| A. | Z的最高价氧化物的水化物是强酸 | |
| B. | Y的最高价氧化物能溶于烧碱溶液 | |
| C. | X与W形成的化合物中含有离子键 | |
| D. | Z、W分别形成的简单离子中,前者的半径较大 |
16.药物吗替麦考酚酯有强大的抑制淋巴细胞增殖的作用,可通过如下反应制得:
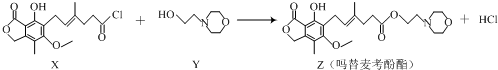
下列叙述正确的是( )

下列叙述正确的是( )
| A. | 化合物X中含有手性碳原子 | B. | 化合物Y的分子式为C6H12NO2 | ||
| C. | 1mol化合物Z可以与3mol NaOH反应 | D. | 用溴水可鉴别化合物X和Z |
20.化学反应中,物质的用量不同或浓度不同或反应条件不同会对生成物产生影响.下列反应的生成物不受反应物的用量或浓度或反应条件影响的是( )
| A. | 二氧化硫与氢氧化钠溶液反应 | B. | 钠与氧气的反应 | ||
| C. | 铁在硫蒸气中燃烧 | D. | 铁粉加入硝酸中 |



