题目内容
5.下列分子属于非极性分子的是( )| A. | H2S | B. | CO2 | C. | NH3 | D. | H2O |
分析 正负电荷重心重合为非极性分子,正负电荷重心不重合为极性分子,结合分子空间构型判断,对于ABn型分子,中心原子A的最外层电子全部成键,为非极性分子,中心原子A的最外层电子部分成键,为极性分子,据此结合选项解答.
解答 解:A.H2S中含有极性键,空间结构为v形,正负电荷的中心不重合,属于极性分子,故A不选;
B.二氧化碳结构对称,正负电荷的中心重合,属于非极性分子,故B选;
C.NH3结构为三角锥形,正负电荷的中心不重合,属于极性分子,故C不选;
D.H2O中含有极性键,空间结构为v形,正负电荷的中心不重合,属于极性分子,故D不选;
故选:B.
点评 本题考查极性分子和非极性分子判断,注意非极性分子的结构对称,正负电荷中心重合是解题关键,题目难度不大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案
相关题目
15.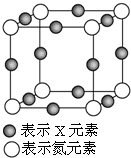 元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体晶胞如图,则下列说法正确的是( )
元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体晶胞如图,则下列说法正确的是( )
 元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体晶胞如图,则下列说法正确的是( )
元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体晶胞如图,则下列说法正确的是( )| A. | X元素的原子序数为28 | |
| B. | 晶体中与一个N3-距离最近的Xn+为8个 | |
| C. | Xn+中n的值为1 | |
| D. | 该晶体中N3-与Xn+的个数比为3:1 |
20.下列第四周期的元素中,最外层电子排布式不是4s1的元素是( )
| A. | 钾 | B. | 钙 | C. | 铬 | D. | 铜 |
10.常温下,将下列物质溶于水中分别配制成0.1 mol•L-1溶液,所得溶液PH大于7的是( )
| A. | NaCl | B. | HCl | C. | NaOH | D. | H2SO4 |
14.下列说法正确的是( )
| A. | 有单质生成的反应一定是氧化还原反应 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 反应前后有元素化合价变化的反应一定是氧化还原反应 | |
| D. | 金属阳离子被还原一定得到金属单质 |