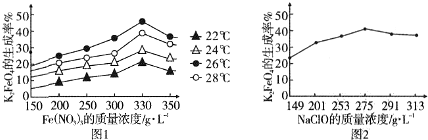
题目内容
13.已知H-H键能为436KJ/mol,H-N键能为391KJ/mol,根据化学方程式:N2+3H2=2NH3 △H=-92.4KJ/mol,则N≡N键的键能是多少?分析 反应中△H=断裂的化学键的键能之和-成键的键能之和,以此来解答.
解答 解:设N≡N键的键能是x,N2+3H2=2NH3 △H=-92.4KJ/mol,则
x+3×436KJ/mol-2×3×391KJ/mol=-92.4KJ/mol,
解得x=945.6KJ/mol,
答:N≡N键的键能是945.66KJ/mol.
点评 本题考查反应热与焓变,为高频考点,把握焓变与键能的关系为解答的关键,侧重分析与计算能力的考查,注意化学键数目的判断,题目难度不大.

练习册系列答案
相关题目
8.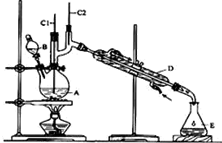 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据如下:
实验步骤如下:
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.
②在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)B仪器的名称是分液漏斗,D仪器的名称是冷凝管.
(2)将正丁醛粗产品置于分液漏斗中分液时,水在下层(填“上”或“下”)
(3)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化(或温度过高被氧化为丁酸).
(4)本实验中,正丁醛的产率为51.5%.(保留三位有效数字)
 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO反应物和产物的相关数据如下:
| 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.
②在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)B仪器的名称是分液漏斗,D仪器的名称是冷凝管.
(2)将正丁醛粗产品置于分液漏斗中分液时,水在下层(填“上”或“下”)
(3)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化(或温度过高被氧化为丁酸).
(4)本实验中,正丁醛的产率为51.5%.(保留三位有效数字)
18.根据表中键能数据.计算反应HC1(g)=$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)的△H=+91.5kJ/mol.
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436 | 243 | 431 |
5.下列分子属于非极性分子的是( )
| A. | H2S | B. | CO2 | C. | NH3 | D. | H2O |
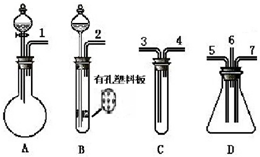 根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:
根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示: