题目内容
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样.若测得该试样中除H+和OH-外其它水溶性离子的化学组分及其平均浓度如下表:
根据表中数据判断试样的pH=
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+
O2(g)=H2O(g)△H=-241.8kJ/molC(s)+
O2(g)=CO(g)△H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K= .汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 .
②目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 .
(1)对PM2.5样本用蒸馏水处理制成待测试样.若测得该试样中除H+和OH-外其它水溶性离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料.已知:H2(g)+
| 1 |
| 2 |
| 1 |
| 2 |
写出焦炭与水蒸气反应的热化学方程式
②洗涤含SO2的烟气,以下物质可作洗涤剂的是
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=
②目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为
考点:用盖斯定律进行有关反应热的计算,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题
分析:(1)先根据溶液中电荷守恒计算氢离子的浓度,然后求出pH;
(2)①写出热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H,利用盖斯定律计算反应热;
②二氧化硫是酸性氧化物,能与和碱或强碱弱酸盐溶液反应;
(3)①计算出平衡时各种物质的物质的量,结合平衡常数的表达式计算;依据化学反应速率和平衡移动原理分析判断;
②根据生成物为氮气和二氧化碳书写.
(2)①写出热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H,利用盖斯定律计算反应热;
②二氧化硫是酸性氧化物,能与和碱或强碱弱酸盐溶液反应;
(3)①计算出平衡时各种物质的物质的量,结合平衡常数的表达式计算;依据化学反应速率和平衡移动原理分析判断;
②根据生成物为氮气和二氧化碳书写.
解答:
解:(1)溶液中电荷守恒:C(K+)+C(NH4+)+C(H+)=2C(SO42-)+C(NO3-)+C(Cl-),得C(H+)=1×10-4mol?L-1,pH值为4,故答案为:4;
(2)①已知:①H2 (g)+
O2 (g)=H2O(g)△H=-241.81kJ?mol-1,
②C (s)+
O2 (g)=CO (g)△H=-110.51kJ?mol-1,
利用盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g)△H=(-110.51kJ?mol-1)-(-241.81kJ?mol-1)=++13l.3 kJ?mol-1;
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3 kJ?mol-1;
②洗涤含SO2的烟气,根据酸性氧化物的性质选a.Ca(OH)2 b.Na2CO3,故答案为:a、b;
(3)①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.若气缸中进入1mol空气(1mol空气含有0.8mol N2和0.2mol O2),1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol,反应前后气体物质的量相同,计算平衡常数时可以用物质的量代替平衡浓度计算,先计算物质的平衡量,N2为0.8mol-4×10-4 mol,O2为0.2mol-4×10-4 mol,带入平衡常数表达式即可,书写计算得K=
=
=4×10-6,
气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移;
故答案为:4×10-6;温度升高,反应速率加快,平衡右移;
②汽车尾气系统中装置反应的化学方程式为2CO+2NO
2CO2+N2,故答案为:2CO+2NO
2CO2+N2.
(2)①已知:①H2 (g)+
| 1 |
| 2 |
②C (s)+
| 1 |
| 2 |
利用盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g)△H=(-110.51kJ?mol-1)-(-241.81kJ?mol-1)=++13l.3 kJ?mol-1;
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3 kJ?mol-1;
②洗涤含SO2的烟气,根据酸性氧化物的性质选a.Ca(OH)2 b.Na2CO3,故答案为:a、b;
(3)①已知气缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0.若气缸中进入1mol空气(1mol空气含有0.8mol N2和0.2mol O2),1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol,反应前后气体物质的量相同,计算平衡常数时可以用物质的量代替平衡浓度计算,先计算物质的平衡量,N2为0.8mol-4×10-4 mol,O2为0.2mol-4×10-4 mol,带入平衡常数表达式即可,书写计算得K=
| c2(NO) |
| c(N2)c(O2) |
| (8×10-4) 2 |
| (0.8-4×10-4)×(0.2-4×10-4) |
气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移;
故答案为:4×10-6;温度升高,反应速率加快,平衡右移;
②汽车尾气系统中装置反应的化学方程式为2CO+2NO
| ||
| ||
点评:本题综合考查化学反应原理的基础知识,涉及PH值的计算、盖斯定律的应用、化学平衡常数的计算等,题目难度中等,注意相关知识的积累.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
从某些性质看,NH3与H2O、NH
与H3O+、NH
与OH-、NH2-与O2-相似,下列有关化学方程式不正确的是( )
+ 4 |
- 2 |
| A、氯化铵与KNH2反应:NH4Cl+KNH2═KCl+2NH3↑ |
| B、二价活泼金属M与液氨反应:M+2NH3═M(NH2)2+H2↑ |
| C、盐酸与MNH反应:2HCl+MNH═MCl2+NH3↑ |
| D、氯化铵与MO反应:2NH4Cl+MO═M(NH2)2+2HCl+H2O |
下列叙述中,不能用勒夏特列原理解释的是( )
| A、红棕色的NO2,加压后颜色先变深后变浅 |
| B、高压比常压有利于合成SO3的反应 |
| C、加入催化剂有利于氨的合成 |
| D、工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
向恒温、恒容(2L)的密闭容器中充入2mol SO2和一定量的O2,发生反应:2SO2(g)+O2(g)
2SO3(g)△H=-197.74kJ?mol-1,4min后达到平衡,这时c(SO2)=0.2mol?L-1,且SO2和O2的转化率相等.下列说法中,不正确的是( )
| 一定条件 |
| A、2 min时,c(SO2)=0.6 mol?L-1 |
| B、用O2表示4 min内的反应速率为0.1 mol?(L?min)-1 |
| C、再向容器中充入1 mol SO3,达到新平衡,n(SO2):n(O2)=2:1 |
| D、4 min后,若升高温度,平衡向逆方向移动,平衡常数K减小 |
在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液.观察到的现象是先出现黄色沉淀.最终出现黑色沉淀.已知有关物质的溶度积Ksp(25℃)如下:下列叙述错误的是( )
| AgCl | AgI | Ag2S | |
| Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
| A、沉淀转化的实质就是沉淀溶解平衡的移动 |
| B、溶解度小的沉淀可以转化为溶解度更小的沉淀 |
| C、AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同 |
| D、25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同 |
关于如图进行的实验的说法,正确的是( )
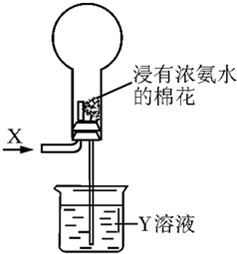

| A、若X为HCl,则烧瓶内可产生白雾 |
| B、选择适当的X和Y溶液可产生有色喷泉 |
| C、若烧瓶内产生喷泉,则Y溶液一定呈酸性 |
| D、若通入气体为Cl2,则烧瓶内一定无喷泉产生 |
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.
 、
、 外,其余的结构简式:
外,其余的结构简式: