题目内容
实验室需要配制100mL 2.0mol?L-1的NaOH溶液.现有以下仪器:托盘天平(带砝码、镊子)、烧杯、玻璃棒、药匙、洗瓶.
(1)还缺少 仪器.
(2)实验时需准确称量NaOH固体 g.
(3)该实验中若出现如下情况(其他操作正确),所配溶液浓度偏低的有 .
①溶解转移后未洗涤烧杯和玻璃棒;
②定容时加水超过了刻度线,用胶头滴管吸出一些溶液使液面达到刻度线;
③搅拌或转移溶液时有液体溅出;
④定容时,俯视刻度线;
⑤称取固体时,药品与砝码的位置放反.
(4)取所配制的NaOH溶液25mL与一定质量的铝充分反应,铝全部溶解后,收集到生成的气体体积为1344mL(已换算成标准状况下).
已知:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
求:①参加反应的铝的质量.
②反应后溶液中OH-物质的量浓度(假设反应前后溶液体积不变).(要求书写计算过程和结果)
(1)还缺少
(2)实验时需准确称量NaOH固体
(3)该实验中若出现如下情况(其他操作正确),所配溶液浓度偏低的有
①溶解转移后未洗涤烧杯和玻璃棒;
②定容时加水超过了刻度线,用胶头滴管吸出一些溶液使液面达到刻度线;
③搅拌或转移溶液时有液体溅出;
④定容时,俯视刻度线;
⑤称取固体时,药品与砝码的位置放反.
(4)取所配制的NaOH溶液25mL与一定质量的铝充分反应,铝全部溶解后,收集到生成的气体体积为1344mL(已换算成标准状况下).
已知:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
求:①参加反应的铝的质量.
②反应后溶液中OH-物质的量浓度(假设反应前后溶液体积不变).(要求书写计算过程和结果)
考点:配制一定物质的量浓度的溶液,化学方程式的有关计算
专题:
分析:(1)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)依据m=CVM计算需要溶质的质量;
(3)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(4)依据:2Al+2NaOH+2H2O=2NaAlO2+3H2↑进行计算.
(2)依据m=CVM计算需要溶质的质量;
(3)根据c=
| n |
| V |
(4)依据:2Al+2NaOH+2H2O=2NaAlO2+3H2↑进行计算.
解答:
解:(1)配制100mL 2.0mol?L-1的NaOH溶液的操作步骤为:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶,用到的仪器依次为:
量托盘天平(带砝码、镊子)、药匙、烧杯、玻璃棒、100mL容量瓶、洗瓶、胶头滴管,还缺少的仪器:100mL容量瓶、胶头滴管;
故答案为:100mL容量瓶、胶头滴管;
(2)配制100mL 2.0mol?L-1的NaOH溶液需要氢氧化钠的质量m=0.1L×2.0mol?L-1×40g/mol=8.0g;
故答案为:8.0;
(3)①溶解转移后未洗涤烧杯和玻璃棒导致溶质的物质的量偏小,溶液的浓度偏低,故①正确;
②定容时加水超过了刻度线,用胶头滴管吸出一些溶液使液面达到刻度线,导致溶质的物质的量偏小,溶液的浓度偏低,故②正确;
③搅拌或转移溶液时有液体溅出,导致溶质的物质的量偏小,溶液的浓度偏低,故③正确;
④定容时,俯视刻度线,导致溶液的体积偏大,溶液的浓度偏低,故④错误;
⑤称取固体时,药品与砝码的位置放反,没有使用游码对称量不会造成影响,溶液的浓度不变,故⑤错误;
故选:①②③;
(4)①25mL2.0mol?L-1的NaOH溶液含有氢氧化钠的物质的量n=0.025L×2.0mol?L-1=0.05mol,1344mL氢气的物质的量=
=0.06mol,依据铝与氢氧化钠反应方程式可知:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 2 3
n(Al)n(NaOH) 0.06mol
=
=
解得:n(Al)=0.04mol;n(NaOH)=0.04mol;
参加反应的铝的质量m(Al)=0.04mol×27g/mol=1.08g;
答:参加反应的铝的质量1.08g;
反应后溶液中OH-物质的量浓度C(OH-)=
=0.4mol/L;
答:反应后溶液中OH-物质的量浓度0.4mol/L.
量托盘天平(带砝码、镊子)、药匙、烧杯、玻璃棒、100mL容量瓶、洗瓶、胶头滴管,还缺少的仪器:100mL容量瓶、胶头滴管;
故答案为:100mL容量瓶、胶头滴管;
(2)配制100mL 2.0mol?L-1的NaOH溶液需要氢氧化钠的质量m=0.1L×2.0mol?L-1×40g/mol=8.0g;
故答案为:8.0;
(3)①溶解转移后未洗涤烧杯和玻璃棒导致溶质的物质的量偏小,溶液的浓度偏低,故①正确;
②定容时加水超过了刻度线,用胶头滴管吸出一些溶液使液面达到刻度线,导致溶质的物质的量偏小,溶液的浓度偏低,故②正确;
③搅拌或转移溶液时有液体溅出,导致溶质的物质的量偏小,溶液的浓度偏低,故③正确;
④定容时,俯视刻度线,导致溶液的体积偏大,溶液的浓度偏低,故④错误;
⑤称取固体时,药品与砝码的位置放反,没有使用游码对称量不会造成影响,溶液的浓度不变,故⑤错误;
故选:①②③;
(4)①25mL2.0mol?L-1的NaOH溶液含有氢氧化钠的物质的量n=0.025L×2.0mol?L-1=0.05mol,1344mL氢气的物质的量=
| 1.344L |
| 22.4L/mol |
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 2 3
n(Al)n(NaOH) 0.06mol
| 2 |
| n(Al) |
| 3 |
| 0.06mol |
| 2 |
| n(Al) |
| 3 |
| 0.06mol |
参加反应的铝的质量m(Al)=0.04mol×27g/mol=1.08g;
答:参加反应的铝的质量1.08g;
反应后溶液中OH-物质的量浓度C(OH-)=
| 0.05mol-0.04mol |
| 0.025L |
答:反应后溶液中OH-物质的量浓度0.4mol/L.
点评:本题考查了配制一定物质的量浓度的溶液方法及有关方程式的化学反应计算,明确配制的原理及过程是解题关键,注意根据化学反应进行的简单计算方法.

练习册系列答案
相关题目
现将0.5mo1Cu2S与72克FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、C(NO3)2、CuSO4的混合溶液,并产生NO气体.则最终反应所得NO物质的量为( )
| A、3.5 mo1 |
| B、2.5 mo1 |
| C、3 mo1 |
| D、2 mo1 |
下列事实中能说明亚硝酸(HNO2)是弱电解质的是( )
| A、亚硝酸不与氯化钠反应 |
| B、用HNO2溶液做导电试验,灯光较暗 |
| C、HNO2不稳定 |
| D、常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L |


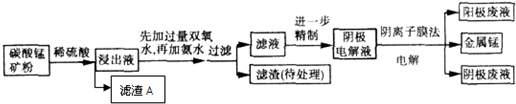

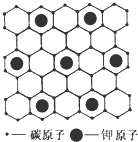 石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳原子中.比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CnK,其平面图形见图,则n值为( )
石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳原子中.比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CnK,其平面图形见图,则n值为( )