题目内容
3.根据反应①Fe+Cu2+═Fe2++Cu
②2Fe3++Cu═Cu2++2Fe2+;
③2Fe2++Cl2═2Fe3++2Cl-
④HClO+H++Cl-═Cl2+H2O
可以判断出各微粒的氧化性由强到弱的顺序正确的是( )
| A. | HClO>Cl2>Fe3+>Cu2+>Fe2+ | B. | Cl2>HClO>Fe3+>Cu2+>Fe2+ | ||
| C. | Cl2>Fe3+>HClO>Cu2+>Fe2+ | D. | HClO>Cl2>Cu2+>Fe3+>Fe2+. |
分析 在同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,据此分析解答.
解答 解:①Fe+Cu2+=Fe2++Cu中铜离子是氧化剂,亚铁离子是氧化产物,所以氧化性Cu2+>Fe2+;
②2Fe3++Cu=Cu2++2Fe2+中铁离子是氧化剂,铜离子是氧化产物,所以氧化性Fe3+>Cu2+;
③2Fe2++Cl2=2Fe3++2Cl-中氯气是氧化剂,铁离子是氧化产物,所以氧化性Cl2>Fe3+;
④HClO+H++Cl-=H2O+Cl2中次氯酸是氧化剂,氯气是氧化产物,所以氧化性HClO>Cl2,
所以氧化性由强到弱的顺序正确的是HClO>Cl2>Fe3+>Cu2+>Fe2+,
故选A.
点评 本题考查氧化还原反应,侧重于考查学生分析和解决问题的能力,可以根据氧化剂的氧化性强于氧化产物的氧化性行回答,题目难度不大.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
11.如表实验方案中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热.冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 测定中和热 | 取0.5mol.L-1的盐酸与0.55mol.L-1的NaOH溶液各50ml混合用量热器测定温度变化. |
| D | 验证浓度对化学平衡的影响 | 向0.1mol.L-1的重铬酸钾溶液中滴几滴浓硫酸观察颜色,再滴几滴NaOH溶液观察颜色变化. |
| A. | A | B. | B | C. | C | D. | D |
18.下列离子在给定条件下,一定能大量共存的是( )
| A. | 25℃时,水电离出的c(H+)=1×l0-l3 mol/L的溶液中:K+、Ba2+、NO3-、I- | |
| B. | 某无色透明的溶液中:Ca2+、NH4+、HCO3-、CH3COO- | |
| C. | 0.1 mol/L的AlCl3溶液中:Na+、K+、SO42-、S2- | |
| D. | c(H+)=$\sqrt{{K}_{W}}$的溶液中:Na+、Fe3+、CH3COO-、NO3- |
8.在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)?3C(g)+D(s),达到平衡时,C的浓度为1.2mol/L,维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度还是1.2mol/L的是( )
| A. | 1mol A+0.5mol B+1.5mol C+0.1mol D | |
| B. | 3mol C+0.5mol D | |
| C. | 2mol A+1mol B+1molD | |
| D. | 0.5mol A+0.25mol B+2.25mol C |
15.下列有机物中能与NaOH溶液发生反应的是( )
①甲苯 ②乙酸 ③乙醇 ④乙酸乙酯 ⑤油脂.
①甲苯 ②乙酸 ③乙醇 ④乙酸乙酯 ⑤油脂.
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ②④⑤ |
12.下列说法正确的是( )
| A. | 棉花和蚕丝的主要成分都是纤维素 | |
| B. | 淀粉和蛋白质在一定条件下都能发生水解反应生成葡萄糖 | |
| C. | 食用植物油的主要成分是不饱和高级脂肪酸甘油酯,属于高分子化合物 | |
| D. | 由青蒿素(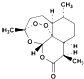 )合成双氢青蒿素( )合成双氢青蒿素(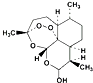 )的反应属于加成反应 )的反应属于加成反应 |
