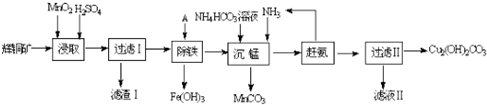
题目内容
8.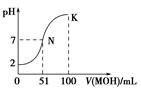 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中错误的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法中错误的是( )| A. | HA为一元强酸 | |
| B. | MOH为一元弱碱 | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.01 mol•L-1 |
分析 0.01mol•L-1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,酸或碱性溶液抑制水电离,含有弱根离子的盐促进水电离,根据物料守恒,电荷守恒,计算K点c(A-)=c(MOH)+c(OH-)-c(H+)的值.
解答 解:A.0.01mol•L-1 HA溶液中pH=2,则HA是强酸,故A正确;
B.N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,故B正确;
C.N点溶液呈中性,K点溶液呈碱性,碱性溶液抑制水电离,所以N点水的电离程度大于K点水的电离程度,故C正确;
D.100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1MOH溶液100mL,此时得到的是等浓度的MA和MOH,根据电荷守恒和物料守恒,得到c(A-)=c(MOH)+c(OH-)-c(H+)=0.005 mol•L-1,故D错误;
故选D.
点评 本题考查了酸碱混合时的定性判断,注意根据酸溶液的pH和酸的浓度确定酸的强弱,为易错点.

练习册系列答案
相关题目
19.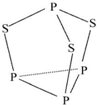 三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
 三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如图所示.下列有关三硫化四磷的说法中正确的是( )| A. | 该物质中磷元素的化合价为+3 | |
| B. | 该物质分子中不含非极性共价键 | |
| C. | 该物质的熔、沸点比P4低 | |
| D. | 该物质22 g含硫原子的数目约为1.806×1023 |
16.根据下表中五种元素的电离能数据(单位:kJ•mol-1),下列说法不正确的是( )
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| u | 420 | 3100 | 4400 | 5900 |
| A. | T的氯化物最可能的化学式为TCl3 | |
| B. | 氦元素最有可能与Q元素位于同一族 | |
| C. | 在同周期表中,最可能处于同一族的是R和U | |
| D. | U元素最有可能为K,R元素最有可能为Li |
13.20世纪70年代末,由于高压技术的发展,一些实验室能使氢在-268.8℃、1.013×107 Pa下变成能导电的固态“金属氢”.关于氢的下列说法中,错误的是( )
| A. | 氢是宇宙物质中含量最多的元素 | |
| B. | 氢是名副其实的碱金属元素 | |
| C. | 氢气是无污染的新型能源 | |
| D. | 固态“金属氢”汽化的过程属于物理变化 |
20.在我们的日常生活中出现了“加碘食盐”“高钙牛奶”“含氟牙膏”等商品.这里的碘、钙、氟指的是( )
| A. | 元素 | B. | 单质 | C. | 分子 | D. | 原子 |
18.下列有关叙述中正碗的是( )
| A. | 常温下,pH=4.3 的 CH3COOH与 CH3COONa 混合溶液中 tc(Na+)<c(CH3COO-) | |
| B. | NaCl溶液和CH3COONH4,溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 相同温度下,若Ksp(AgCL)>KspCAg2CrCO4),则 AgCl的溶解度大于Ag2CrCO4 | |
| D. | 向冰醣酸加少就水稀释,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$增大 |
 碳、氮在自然界中广泛存在.
碳、氮在自然界中广泛存在.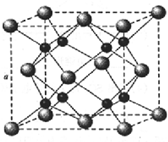 A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题: