题目内容
为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:将铜粉在坩埚中反复灼烧,与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入铜粉与稀硫酸的混合物中,向反应液中加FeSO4或Fe2(SO4)3,即发生反应.反应完全后加CuCO3调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶得CuSO4?5H2O.滤渣可循环使用.
(1)写出加入FeSO4或Fe2(SO4)3后发生反应的相关的离子方程式 .
第二组:过氧化氢为氧化剂法
将少量铜丝放到适量的稀硫酸中,温度控制在50℃.加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后.过滤、蒸发结晶等,用少量95%的酒精淋洗后晾干,得CuSO4?5H2O.
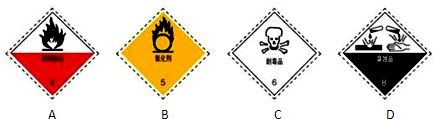
(2)过氧化氢试剂瓶最适合贴上的一个标签是 .
(3)若需要得到25.0g硫酸铜晶体,至少需要30%(密度为1.1g/cm3 )的H2O2 mL.
(4)上述两种氧化法中,更符合绿色化学理念(从产品的纯度和能源的消耗角度)的是 (填“第一组”或“第二组”),理由是 .
第一组:以空气为氧化剂法
方案1:将铜粉在坩埚中反复灼烧,与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入铜粉与稀硫酸的混合物中,向反应液中加FeSO4或Fe2(SO4)3,即发生反应.反应完全后加CuCO3调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶得CuSO4?5H2O.滤渣可循环使用.
(1)写出加入FeSO4或Fe2(SO4)3后发生反应的相关的离子方程式
第二组:过氧化氢为氧化剂法
将少量铜丝放到适量的稀硫酸中,温度控制在50℃.加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后.过滤、蒸发结晶等,用少量95%的酒精淋洗后晾干,得CuSO4?5H2O.
(2)过氧化氢试剂瓶最适合贴上的一个标签是

(3)若需要得到25.0g硫酸铜晶体,至少需要30%(密度为1.1g/cm3 )的H2O2
(4)上述两种氧化法中,更符合绿色化学理念(从产品的纯度和能源的消耗角度)的是
考点:化学试剂的分类,离子方程式的书写,溶液的配制
专题:元素及其化合物
分析:(1)二价铁能被氧气氧化为三价铁,三价铁能将铜氧化;
(2)过氧化氢有强氧化性;
(3)根据方程式进行计算;
(4)第一组方案1需要灼烧,方案2所得产品含有铁元素杂质;方案1产生有毒气体氮的氧化物,而第二组方案几乎不产生有害气体.
(2)过氧化氢有强氧化性;
(3)根据方程式进行计算;
(4)第一组方案1需要灼烧,方案2所得产品含有铁元素杂质;方案1产生有毒气体氮的氧化物,而第二组方案几乎不产生有害气体.
解答:
解:(1)二价铁能被氧气氧化为三价铁,三价铁能将铜氧化,离子方程式:4Fe2++O2+4H+=4Fe3++2H2O;2Fe3++Cu=Cu2++2Fe2+,故答案为:4Fe2++O2+4H+=4Fe3++2H2O;2Fe3++Cu=Cu2++2Fe2+;
(2)过氧化氢有强氧化性,是氧化剂,故答案为:B;
(3)25.0g硫酸铜的物质的量为0.1mol,设需要30%(密度为1.1g/cm3 )的H2O2XmL.
Cu+H2O2+H2SO4=CuSO4+2H2O
34 1
1.1X×30% 0.1
=
故答案为:10.3;
(4)第一组方案1需要灼烧,所以多消耗能源;第一组方案2所得产品含有铁元素杂质,产品不纯;第一组方案1产生有毒气体氮的氧化物,而第二组方案几乎不产生有害气体,且所得产品纯度较高,
故答案为:第二组;第一组方案1需要灼烧,多消耗能源;第一组方案2所得产品含有铁元素杂质;而第二组方案几乎不产生有害气体,且所得产品纯度高.
(2)过氧化氢有强氧化性,是氧化剂,故答案为:B;
(3)25.0g硫酸铜的物质的量为0.1mol,设需要30%(密度为1.1g/cm3 )的H2O2XmL.
Cu+H2O2+H2SO4=CuSO4+2H2O
34 1
1.1X×30% 0.1
| 34 |
| 1.1X×30% |
| 1 |
| 0.1 |
故答案为:10.3;
(4)第一组方案1需要灼烧,所以多消耗能源;第一组方案2所得产品含有铁元素杂质,产品不纯;第一组方案1产生有毒气体氮的氧化物,而第二组方案几乎不产生有害气体,且所得产品纯度较高,
故答案为:第二组;第一组方案1需要灼烧,多消耗能源;第一组方案2所得产品含有铁元素杂质;而第二组方案几乎不产生有害气体,且所得产品纯度高.
点评:本题考查了学生对实验原理的理解、实验方案的评价、实验装置的理解与评价、常用化学用语、物质推断、实验条件控制等,难度中等,实验方案设计,应根据实验目的思考实验原理,根据实验原理中反应物的状态和反应条件确定试剂和装置,通过比较和评价优选最佳实验方案.

练习册系列答案
相关题目
下列判断中,正确的是( )
| A、可用NaOH溶液除去乙酸乙酯中混有的少量乙酸和乙醇 |
| B、可用水区别四种有机溶剂:苯、四氯化碳、己烯、无水乙醇 |
| C、淀粉水解的最终产物能与新制的氢氧化铜悬浊液反应生成砖红色的沉淀 |
| D、蒸馏“地沟油”可以获得甘油 |
25℃时,0.1mol/L的NaB溶液的pH=8,将该NaB溶液与0.06mol/L的盐酸等体积混合(混合时溶液体积变化忽略不计),下列说法中不正确的是( )
| A、混合溶液中:c(HB)+c(B-)=0.05mol/L |
| B、混合溶液中:c(OH-)+c(B-)-c(H+)=0.04mol/L |
| C、该NaB溶液中:c(H+)+c(HB)=1.0×10-6mol/L |
| D、该NaB溶液中:c(Na+)-c(B-)=9.9×10-7mol/L |
下列各选项中所述的两个量,前者一定大于后者的是( )
| A、pH=10的NaOH和Na2CO3溶液中,水的电离程度 |
| B、物质的量浓度相等的NH4NO3溶液和氨水中NH4+的物质的量浓度 |
| C、将pH=3的盐酸和醋酸分别加水稀释成pH=5的溶液,所加水的量 |
| D、相同温度下,10mL 0.1mol?L-1的醋酸和100mL 0.01mol?L-1的醋酸中H+物质的量 |
下列叙述错误的是( )
| A、蛋白质、纤维素、蔗糖、PVC、淀粉都是高分子化合物 |
| B、氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 |
| C、加热能杀死流感病毒是因为病毒的蛋白质受热变性 |
| D、合金材料中可能含有非金属元素 |
下列说法正确的是( )
| A、油脂、淀粉、蔗糖和葡萄糖在一定条件都能发生水解反应 |
| B、根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间 |
| C、棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| D、蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素 |
已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A、质子数:a>c>b>d |
| B、离子的还原性:Y2->Z- |
| C、离子半径:Y2->Z->X+>W3+ |
| D、元素电负性大小顺序:Y>Z |
