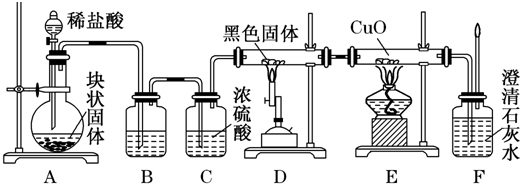
题目内容
 (1)有A、B、C、D四种金属,已知:只有D投入水中可与水剧烈反应;用B和C作电极,稀硫酸作电解质溶液构成原电池时,C为正极;A和C的离子共存于电解液中,以石墨为电极电解时阴极析出A.则这四种金属的活动性由强到弱的顺序是
(1)有A、B、C、D四种金属,已知:只有D投入水中可与水剧烈反应;用B和C作电极,稀硫酸作电解质溶液构成原电池时,C为正极;A和C的离子共存于电解液中,以石墨为电极电解时阴极析出A.则这四种金属的活动性由强到弱的顺序是(2)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2═2H2O,电解质溶液为稀H2SO4溶液,电池放电时是将
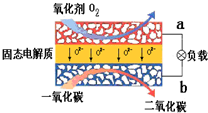
(3)如图为固态氧化物燃料电池(SOFC)的原理示意图.
试写出电极反应式:
A.ZrO(氧化锆) B.NaOH C.Na2SO4.
考点:原电池和电解池的工作原理,常见金属的活动性顺序及其应用
专题:
分析:(1)金属越活泼,与水反应越剧烈;一般来说,作原电池负极的金属活动性较强;在电解池中,阴极上氧化性较强的离子先放电,金属离子的氧化性越强,对应的金属单质越不活泼,以此解答该题;
(2)根据反应2H2+O2=2H2O可知,反应中氢气失电子被氧化,应在负极上的反应,氧气得电子被还原,应在正极上的反应,根据得失电子及反应类型写出相应的电极反应式;
(3)负极失电子,正极得电子,电子由负极移向正极,氧化锆有自由移动的O2-.
(2)根据反应2H2+O2=2H2O可知,反应中氢气失电子被氧化,应在负极上的反应,氧气得电子被还原,应在正极上的反应,根据得失电子及反应类型写出相应的电极反应式;
(3)负极失电子,正极得电子,电子由负极移向正极,氧化锆有自由移动的O2-.
解答:
解:(1)D投入水中可与水剧烈反应,说明D最活泼;
用B和C作电极,稀硫酸作电解质溶液构成原电池时,C为正极,说明金属的活动性B>C;
A和C的离子共存于电解液中,以石墨为电极电解时阴极析出A,说明金属活动性C>A;
则四种金属的活动性由强到弱的顺序是D>B>C>A,
故答案为:DBCA;
(2)氢氧燃料电池是将化学能转化为电能的装置,该反应在酸性环境中,负极上氢气失电子被氧化,氢气失电子生成氢离子,所以电极反应式为2H2-4e-═4H+
正极上氧气得电子被还原,氧气得电子和溶液中的氢离子生成水,所以电极反应式为O2+4H++4e-═2H2O;
故答案为:化学能;电能;2H2-4e-═4H+;O2+4H++4e-═2H2O;
(3)负极失电子:CO+O2--2e-=CO2,正极得电子:O2+4e-=2O2-,电子由负极移向正极,在导线中电子由a←b,氧化锆有自由移动的O2-,可做电解质,氧化锆高温下才发生电离,故答案为:O2+4e-=2O2-;CO+O2--2e-=CO2;b→a; A.
用B和C作电极,稀硫酸作电解质溶液构成原电池时,C为正极,说明金属的活动性B>C;
A和C的离子共存于电解液中,以石墨为电极电解时阴极析出A,说明金属活动性C>A;
则四种金属的活动性由强到弱的顺序是D>B>C>A,
故答案为:DBCA;
(2)氢氧燃料电池是将化学能转化为电能的装置,该反应在酸性环境中,负极上氢气失电子被氧化,氢气失电子生成氢离子,所以电极反应式为2H2-4e-═4H+
正极上氧气得电子被还原,氧气得电子和溶液中的氢离子生成水,所以电极反应式为O2+4H++4e-═2H2O;
故答案为:化学能;电能;2H2-4e-═4H+;O2+4H++4e-═2H2O;
(3)负极失电子:CO+O2--2e-=CO2,正极得电子:O2+4e-=2O2-,电子由负极移向正极,在导线中电子由a←b,氧化锆有自由移动的O2-,可做电解质,氧化锆高温下才发生电离,故答案为:O2+4e-=2O2-;CO+O2--2e-=CO2;b→a; A.
点评:本题考查原电池反应(反应原理、电极方程式的书写、离子的移动方向)和有关化学方程式的计算,难度不大,注意电解质的选择方法.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
下列溶液颜色变化的原理和其他原理不同的是( )
| A、酸性KMnO4溶液中通入SO2气体后紫色消失 |
| B、显红色的酚酞溶液通入SO2气体后红色消失 |
| C、氯化铁溶液中通入SO2气体后溶液变色 |
| D、溴水通入SO2气体后橙色消失 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、0.1mol?L-1的Na2CO3溶液中,阴离子的总数目大于0.1NA |
| B、常温下,46 g NO2和N2O4混合气体中含有的分子总数为2NA |
| C、标准状况下,22.4L的HF含有NA个分子 |
| D、标准状况下,10g的庚烷分子中含有2.2NA个共价键 |
 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验:
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验: