题目内容
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如图①所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的10电子分子,溶于水显碱性;甲、乙为非金属单质;X分子含有10个电子,常温下为无色液体.它们之间的转化关系如图②所示.请回答下列问题:
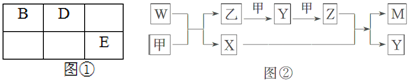
(1)Z的化学式为
(2)乙的电子式为 .
(3)惰性电极电解NaE溶液的离子方程式为 .
(4)W与甲反应方程式为 .
(5)将一定量的A2、B2的混合气体放入1L密闭容器中,在500℃、2×107Pa下达到平衡.测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol.则该条件下A2的平衡转化率为 ,该温度下的平衡常数为 (结果保留3位有效数字).

(1)Z的化学式为
(2)乙的电子式为
(3)惰性电极电解NaE溶液的离子方程式为
(4)W与甲反应方程式为
(5)将一定量的A2、B2的混合气体放入1L密闭容器中,在500℃、2×107Pa下达到平衡.测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol.则该条件下A2的平衡转化率为
考点:位置结构性质的相互关系应用,无机物的推断
专题:推断题,元素周期律与元素周期表专题
分析:A元素原子的核外电子数、电子层数和最外层电子数均相等,判断为H元素,B、D、E三种元素在周期表中相对位置如表①所示,应为二三周期的元素,只有E元素的单质能与水反应生成两种酸,结合物质性质和结构判断E为Cl元素;所以B为N元素,D为氧元素;甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素依据转化关系推断为HNO3;判断Z为NO2,Y为NO,甲、乙为非金属单质,甲为O2,乙为N2;X分子中含有10个电子判断X为H2O,W为A、B两元素组成的10电子分子,溶于水显碱性,判断为NH3,据此答题;
解答:
解:A元素原子的核外电子数、电子层数和最外层电子数均相等,判断为H元素,B、D、E三种元素在周期表中相对位置如表①所示,应为二三周期的元素,只有E元素的单质能与水反应生成两种酸,结合物质性质和结构判断E为Cl元素;所以B为N元素,D为氧元素;甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素依据转化关系推断为HNO3;判断Z为NO2,Y为NO,甲、乙为非金属单质,甲为O2,乙为N2;X分子中含有10个电子判断X为H2O,W为A、B两元素组成的10电子分子,溶于水显碱性,判断为NH3,
(1)由上面的分析可知,Z为二氧化氮,化学式为NO2,故答案为:NO2;
(2)乙为氮气,它的电子式为 ,故答案为:
,故答案为: ;
;
(3)惰性电极电解NaCl溶液的离子方程式为 2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(4)W为NH3,甲为氧气,根据图②可知,它们生成氮气和水,所以反应方程式为4NH3+3O2
2N2+6H2O,故答案为:4NH3+3O2
2N2+6H2O;
(5)依据推断可知A为氢元素,B为氮元素;将一定量的A2、B2混合气体放入1L密闭容器中,在500℃、2×10?Pa下达到平衡.反应为N2+3H2=2NH3,测得平衡时混合气体的总物质的量为0.5mol,其中H2为0.3mol,N2为0.1mol.平衡混合物NH3为0.1mol,
N2 +3H2=2NH3,
起始量(mol) 0.15 0.45 0
变化量(mol ) 0.05 0.15 0.1
平衡量(mol) 0.1 0.3 0.1
则该条件下氢气的转化率=
×100%=33.3%;
平衡浓度为:c(N2)=0.1mol/L c(H2)=0.3mol/L c(NH3)=0.1mol/L;
平衡常数K=
=
=3.7;
故答案为:33.3%; 3.7;
(1)由上面的分析可知,Z为二氧化氮,化学式为NO2,故答案为:NO2;
(2)乙为氮气,它的电子式为
 ,故答案为:
,故答案为: ;
;(3)惰性电极电解NaCl溶液的离子方程式为 2Cl-+2H2O
| ||
| ||
(4)W为NH3,甲为氧气,根据图②可知,它们生成氮气和水,所以反应方程式为4NH3+3O2
| ||
| △ |
| ||
| △ |
(5)依据推断可知A为氢元素,B为氮元素;将一定量的A2、B2混合气体放入1L密闭容器中,在500℃、2×10?Pa下达到平衡.反应为N2+3H2=2NH3,测得平衡时混合气体的总物质的量为0.5mol,其中H2为0.3mol,N2为0.1mol.平衡混合物NH3为0.1mol,
N2 +3H2=2NH3,
起始量(mol) 0.15 0.45 0
变化量(mol ) 0.05 0.15 0.1
平衡量(mol) 0.1 0.3 0.1
则该条件下氢气的转化率=
| 0.15mol |
| 0.45mol |
平衡浓度为:c(N2)=0.1mol/L c(H2)=0.3mol/L c(NH3)=0.1mol/L;
平衡常数K=
| c2(NH3) |
| c(N2)c3(H2) |
| 0.12 |
| 0.1×0.33 |
故答案为:33.3%; 3.7;
点评:本题考查了物质性质的分析判断,物质转化的推断方法和物质性质的应用,化学平衡计算、电解池原理的应用是解题关键,题目难度中等.

练习册系列答案
相关题目
焰火“脚印”“笑脸”“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关.下列说法中正确的是( )
| A、非金属单质燃烧时火焰均为无色 |
| B、焰色反应均应透过蓝色钴玻璃观察 |
| C、NaCl与Na2CO3灼烧时火焰颜色相同 |
| D、所有金属及其化合物灼烧时火焰均有颜色 |
 (1)有A、B、C、D四种金属,已知:只有D投入水中可与水剧烈反应;用B和C作电极,稀硫酸作电解质溶液构成原电池时,C为正极;A和C的离子共存于电解液中,以石墨为电极电解时阴极析出A.则这四种金属的活动性由强到弱的顺序是
(1)有A、B、C、D四种金属,已知:只有D投入水中可与水剧烈反应;用B和C作电极,稀硫酸作电解质溶液构成原电池时,C为正极;A和C的离子共存于电解液中,以石墨为电极电解时阴极析出A.则这四种金属的活动性由强到弱的顺序是