题目内容
2.如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g25.00%的NaCl溶液、足量的CuCl2溶液和100g10.00%的H2SO4溶液,电极均为石墨电极.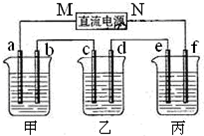
接通电源,经过一段时间后,甲中b电极上得到有刺激性气味的气体,其体积为2.24L(标准状况下).据此回答问题:
(1)电源的M端为负极.
(2)甲烧杯中电极b上发生的电极反应为2Cl--2e-=Cl2.
(3)乙烧杯中电极c的析出的质量是6.4g.
(4)丙烧杯中发生反应的化学方程式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
(5)电解前后甲烧杯中溶液的pH变化情况是变大(选填:“变大”、“变小”或“不变”)简述其原因是甲中电解氯化钠溶液是电解水和氯化钠,溶液中生成NaOH的浓度增大,pH变大.
分析 接通电源,经过一段时间后,甲中b电极上得到有刺激性气味的气体,是氯离子放电生成氯气,其体积为2.24L(标准状况下),物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,整个电路转移电子的物质的量为:0.2mol,所以b是阳极,所以N是正极,根据电极名称结合电解池的工作原理书写电极反应,并根据电子守恒进行相应的计算,由此解答.
解答 解:接通电源,经过一段时间后,甲中b电极上得到有刺激性气味的气体,是氯离子放电生成氯气,其体积为2.24L(标准状况下),物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,所以b是阳极,所以N是正极,
(1)N是正极,电源的M端为负极,故答案为:负极;
(2)甲烧杯中电极b上氯离子发生氧化反应生成氯气,电极反应为:2Cl--2e-=Cl2,故答案为:2Cl--2e-=Cl2;
(3)乙烧杯中电极c是阴极,铜离子放电析出铜,而整个电路转移电子的物质的量为:0.2mol,所以析出铜的物质的量为:0.1mol,所以铜的质量为6.4g,故答案为:6.4g;
(4)丙烧杯中电解100g10.00%的H2SO4溶液,实质是电解水,反应方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,故答案为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
(5)电解前后甲烧杯中是氯化钠溶液,电解是放氢生碱型,所以溶液的pH变大,故答案为:变大;甲中电解氯化钠溶液是电解水和氯化钠,溶液中生成NaOH的浓度增大,pH变大.
点评 本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路,各电极上得失电子的数目相等.做题时要正确写出电极方程式,准确判断两极上离子的放电顺序.

①在溶液中,A+N2+═A2++N;
②D+2H2O═D(OH)2+H2↑;
③以B、E为电极与E的盐溶液组成原电池,电极反应为:M2++2e-═M,N-2e-═N2+.
下列各项比较关系正确的是( )
| A. | 还原性:D>M>N>A | B. | 反应②中H2是氧化产物 | ||
| C. | 金属性:A>N>D>M | D. | 氧化性:M2+>N2+>A2+>D2+ |
| A. | 乙烯水化法制乙醇 | B. | 石油裂解制丙烯 | ||
| C. | 乙醇与乙酸反应制乙酸乙酯 | D. | 乙醛与新制氢氧化铜反应 |
| A. | N2 | B. | H2 | C. | CH2═CH2 | D. | CH≡CH |
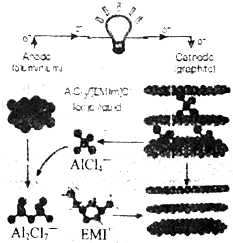 2015年4月,由中美科学家共同完成的“快速充放电铝离子电池”,具有高效耐用、可超快充电、可燃性低、成本低等特点.该电池以金属铝作为负极,三维结构的泡沫石墨材料为正极,AlCl4-可在其中或在脱嵌,由有机离子 (EMI+不参与反应)Al2Cl7-和AlCl4-组成的离子液体做电解质溶液,该电池放电时的原理如图所示,下列说法正确的是( )
2015年4月,由中美科学家共同完成的“快速充放电铝离子电池”,具有高效耐用、可超快充电、可燃性低、成本低等特点.该电池以金属铝作为负极,三维结构的泡沫石墨材料为正极,AlCl4-可在其中或在脱嵌,由有机离子 (EMI+不参与反应)Al2Cl7-和AlCl4-组成的离子液体做电解质溶液,该电池放电时的原理如图所示,下列说法正确的是( )| A. | 放电时,负极的电极反应式:Al-3e-+7AlCl4-═Al2C17- | |
| B. | 充电过程中,AlCl4-脱嵌并从阴极向阳极迁移 | |
| C. | 充电过程中阳极的电极反应式为:Cn+AlCl4--e-═Cn,其中C的化合价升高 | |
| D. | 该离子液体也可用于钢制品上电镀铝,但阴极材料要换成镀件 |
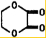 +2H2O.
+2H2O.
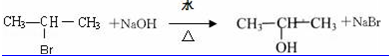 ;
;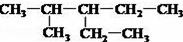 ;
; .
.