题目内容
6.利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量.a中试剂是浓氨水.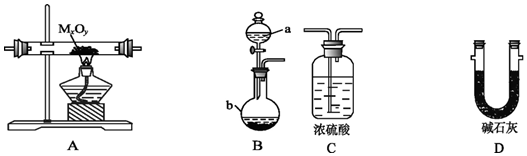
(1)仪器a的名称为分液漏斗,仪器b中装入的试剂可以是NaOH或生石灰或碱石灰.
(2)按气流方向正确的装置连接顺序为(填序号,装置可重复使用):BDADC.
(3)装置C的作用:尾气处理,吸收未反应的NH3;同时防止空气中的水蒸气进入.
(4)实验结束时,应首先Ⅰ(填序号); 这样做的原因是使反应产生的水蒸气全部被碱石灰吸收.
Ⅰ.熄灭A装置的酒精灯Ⅱ.停止从a中滴加液体
(5)若金属氧化物为CuO,反应的化学方程式为2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
(6)若实验中准确称取金属氧化物的质量为m g,完全反应后,测得生成水的质量为n g,则M的相对原子质量为$\frac{(18m-16n)y}{nx}$(用含x、y、m、n的式子表示).
(7)某同学仔细分析上述装置后认为仍存在缺陷,你认为该如何改进?在尾气吸收的浓硫酸前加安全瓶防倒吸.
分析 B用于制备氨气,用D干燥后在加热条件下与A中的金属氧化物发生反应生成水和氮气,用D吸收水,由D的质量增重可确定生成水的质量,结合MxOy~yH2O关系计算M的相对原子质量,装置最后连接C,可用于吸收氨气和空气中的水,应减小实验误差,以此解答该题.
解答 解:(1)仪器a名称为分液漏斗用来盛放和滴加液体,a中试剂是浓氨水,仪器b中加入的是氢氧化钠固体或碱石灰,滴入浓氨水固体溶解放热使一水合氨分解生成氨气,
故答案为:分液漏斗;NaOH或生石灰或碱石灰;
(2)从发生装置中出来的氨气带有水蒸气,必须干燥,故B接D,D接A,吸收反应生成的水用装置D,最后空气中的水不能进入装置D,所以需要装置C,按气流方向正确的装置连接顺序为BDADC,
故答案为:BDADC;
(3)氨气不能完全反应,应用浓硫酸吸收,且为防止空气中的水进入D,应连接浓硫酸,防止空气中的水蒸气进入,
故答案为:尾气处理,吸收未反应的NH3;同时防止空气中的水蒸气进入;
(4)实验结束时应首先熄灭A装置的酒精灯,以使反应生成的水能被碱石灰完全吸收,以减小实验误差,
故答案为:Ⅰ;使反应产生的水蒸气全部被碱石灰吸收;
(5)若金属氧化物为CuO,CuO和氨气在加热条件下发生氧化还原反应生成铜和氮气,反应的化学方程式为2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O,
故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O;
(6)若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,
由MxOy~yH2O关系计算
xM+16y 18y
mg ng
M=$\frac{(18m-16n)y}{nx}$,
则M的相对原子质量为$\frac{(18m-16n)y}{nx}$,
故答案为:$\frac{(18m-16n)y}{nx}$;
(7)氨气易溶于浓硫酸,为防止倒吸,应在尾气吸收的浓硫酸前加安全瓶防倒吸,故答案为:在尾气吸收的浓硫酸前加安全瓶防倒吸.
点评 本题考查了物质组成和产物的实验测定和分析判断,为高频考点,侧重考查学生的分析能力、实验能力和计算能力,主要是实验过程、实验现象、实验装置连接和顺序的理解应用,题目难度中等.

 中考解读考点精练系列答案
中考解读考点精练系列答案| 混合物成分 | 除杂试剂 | 化学方程式 |
| (1)铜粉中混有铁粉 | ||
| (2)铁粉中混有铝粉 | ||
| (3)Al2O3中混有Al(OH)3 | ||
| (4)FeCl3溶液中混有FeCl2 |
| A. | 用Na2O2和H2O 反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 用氢氧化钠溶液除去金属铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 用食醋除去水瓶中的水垢:2CH3COOH+CO32-═2CH3COO-+CO2↑+H2O | |
| D. | 等体积、等浓度的Ba(OH)2浓溶液和NH4HCO3 浓溶液混合后并加热Ba2++OH-+HCO3-═BaCO3↓+2H2O |
| A. | SO2完全转化为SO3 | |
| B. | SO2、O2与SO3的物质的量之比为2:1:2 | |
| C. | 反应混合物中,SO3的质量分数不再改变 | |
| D. | 消耗2 mol SO2的同时生成2 mol SO3 |

(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
装置B中饱和食盐水的作用是除去Cl2中的HCl;
(2)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为黄色,打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,下层(四氯化碳)为紫红色.
(3)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式:2NaOH+Cl2═NaCl+NaClO+H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 无水氯化钙 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
| 反应过程 | 化学方程式 | 不同温度下的K | ||
| 273.15K | 1000K | |||
| Ⅰ | 二甲醚羰基化反应 | CH3OCH3(g)+CO(g)?CH3COOCH3(g) | 1016.25 | 101.58 |
| Ⅱ | 乙酸甲酯加氢反应 | CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g) | 103.97 | 10-0.35 |
(1)二甲醚碳基化反应的△H<0 (填“>”“<”“=”).
(2)若反应在恒温恒容下进行,下列可说明反应已经达到平衡状态的是BD.
A.2v(CH3COOCH3)=v(H2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度保持不变
D.密闭容器中C2H5OH的体积分数保持不变
(3)总反应CH3OCH3(g)+CO(g)+2H2 (g)?CH3OH(g)+C2H5OH(g)的平衡常数表达式K=$\frac{c({C}_{2}{H}_{5}OH)c(C{H}_{3}OH)}{c(C{H}_{3}OC{H}_{3})c(CO){c}^{2}({H}_{2})}$,随温度的升高,总反应的K将减小 (填“增大”、“不变”或“减小”).
(4)在压强为1Mpa条件下,温度对二甲醚和乙酸甲酯平衡转化率影响如图1所示,温度对平衡体系中乙酸甲酯的含量和乙醇含量的影响如图2所示.观察图2可知乙酸甲酯含量在 300K~600K范围内发生变化是随温度升高而增大,简要解释产生这种变化的原因该温度范围,反应Ⅰ转化率都很大,反应Ⅱ的转化率随温度升高而减小,所以乙酸甲酯的含量升高.
(5)将CH3OCH3(g)和CO(g)按物质的量之比1:1充入密闭容器中发生碳基化反应,在T K时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| CH3OCH3(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
| CO(g) | 2.00 | 1.80 | 1.70 | 1.00 | 0.50 | 0.50 |
| CH3COOCH3(g) | 0 | 0.20 | 0.30 | 1.00 | 1.50 | 1.50 |
A.通入一定量的CO B.移出一定量的CH3OCH3C.加入合适的催化剂
②在图3中画出TK,CH3COOCH3(g)的体积分数随反应时间的变化曲线.


 .
. 与Br2,要想得到纯净的该产物,可用NaOH溶液(或水)洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的该产物,可用NaOH溶液(或水)洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.