题目内容
2.下列叙述正确的是( )| A. | 由分子组成的物质中不一定存在共价键 | |
| B. | 金刚石、石墨、足球烯均是碳元素的同素异形体,性质都相似 | |
| C. | 由非金属元素组成的晶体一定是分子晶体 | |
| D. | 仅由非金属元素组成的物质不可能含有离子键 |
分析 A.单原子分子中不含共价键;
B.同素异形体是同种元素形成的不同单质,同素异形体物理性质不同,化学性质相似;
C.由非金属元素组成的晶体可能是离子晶体,也可能是分子晶体或原子晶体;
D.仅由非金属元素组成的化合物中可能含有离子键.
解答 解:A.单原子分子中不含共价键,如稀有气体,故A正确;
B.金刚石、石墨、足球烯均是碳元素形成的不同单质,属于同素异形体,物理性质不同,化学性质相似,故B错误;
C.由非金属元素组成的晶体可能是离子晶体,如铵盐,可能是原子晶体,如二氧化硅,故C错误;
D.仅由非金属元素组成的化合物中可能含有离子键,如铵盐,故D错误;
故选A.
点评 本题考查了物质和化学键的关系,不能根据是否含有金属元素判断离子键,稀有气体分子是单原子分子,不存在化学键,为易错点.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
10. 请回答下列问题:
请回答下列问题:
(1)下列现象和应用与电子跃迁无关的是D、E.
A.激光 B.焰色反应 C.原子光谱 D.燃烧放热 E.石墨导电
(2)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍.某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有12个σ键.
(3)元素铬化合物(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.
①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有Cu、K(填元素符号).
②在a:苯、b:CH3OH、c:HCHO、d:CS2、e:CCl4五种有机溶剂中,碳原子采取sp3杂化的分子有b、e(填字母),CS2分子的键角是1800.
③过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]]2+有(填“无”或“有”)颜色.
 (4)请写出HClO的电子式:
(4)请写出HClO的电子式: .
.
在如图配合物离子[Cu(NH3)4]2+.中的画出配位键:
(5)A、B均为短周期金属元素.依据下表数据和已学知识,
判断金属B的价电子电子排布式3s2,写出金属B与二氧化碳反应的化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
 请回答下列问题:
请回答下列问题:(1)下列现象和应用与电子跃迁无关的是D、E.
A.激光 B.焰色反应 C.原子光谱 D.燃烧放热 E.石墨导电
(2)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍.某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有12个σ键.
(3)元素铬化合物(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.
①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有Cu、K(填元素符号).
②在a:苯、b:CH3OH、c:HCHO、d:CS2、e:CCl4五种有机溶剂中,碳原子采取sp3杂化的分子有b、e(填字母),CS2分子的键角是1800.
③过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]]2+有(填“无”或“有”)颜色.
 (4)请写出HClO的电子式:
(4)请写出HClO的电子式: .
.在如图配合物离子[Cu(NH3)4]2+.中的画出配位键:
(5)A、B均为短周期金属元素.依据下表数据和已学知识,
| 电离能/KJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
17.有一种有机化合物,其结构简式如下:

下列有关它的性质的叙述,正确的是( )

下列有关它的性质的叙述,正确的是( )
| A. | 在一定条件下,1 mol该物质最多能与6 mol NaOH完全反应 | |
| B. | 有弱酸性,1 mol该有机物与溴水反应,最多能消耗4 mol Br2 | |
| C. | 在Ni催化下,1 mol该物质可以和7 mol H2发生加成反应 | |
| D. | 它能发生水解反应,水解后只能生成两种产物 |
7.实验室中下列药品保存方法不正确的是( )
| A. | 少量金属钠保存在煤油中 | |
| B. | 少量NaOH保存在带有玻璃塞的试剂瓶中 | |
| C. | 少量白磷保存在冷水中 | |
| D. | 少量浓硝酸保存在棕色试剂瓶中 |
14.将8.7gMnO2与足量的浓盐酸共热来制取氯气.有关说法正确的为( )
| A. | 可制得14.2g氯气 | B. | 被氧化的HCl的质量为14.6g | ||
| C. | 被氧化的HCl的质量为7.3g | D. | 转移的电子的物质的量为0.2mol |
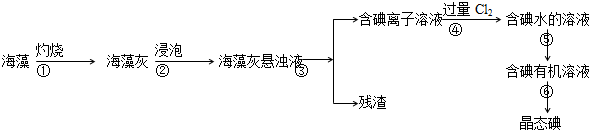
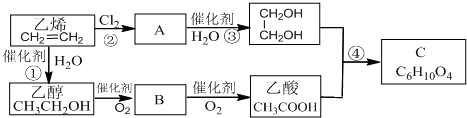
 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.