题目内容
4.已知氮的氧化物是严重的大气污染物,可以通过以下方法处理:Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)
(1)已知:N2(g)+O2(g)?2NO(g)△H=+180kJ/mol
| 化学犍 | O=O | C=0 | C≡O |
| 键能(kJ/mol) | 497 | 803 | 1072 |
(2)在一定温度下,向体积1L的密闭容器中充入2molNO,10min时反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)达到平衡状态,反应过程中反应物浓度随时间的变化如图1所示.
①该反应的平衡常数K的计算式为$\frac{(0.4)^{2}×0.2}{(1.6)^{2}×(0.6)^{2}}$(mol.L)-1,千10min内N2平均反应速率v(N2)0.02mol/(L•min)
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,则此时:v正=v逆(天“>”、“>”或“=”)
③若保持其条件不变,15min时压缩容器至0.5L时反应重新达到平衡,NO的浓度对应的点应是图1中的B(填字母)
④某科研小组研究发现以Ag-ZSM-5为催化剂,NO转化为N2的转化率随温度变化情况如图2所示,若不适用CO,纬度超过775K,发现NO的分解率降低,其可能的原因是NO的分解反应为放热反应,升高温度有利于反应逆向进行
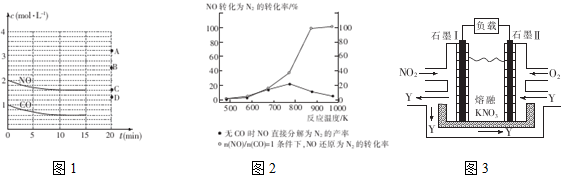
Ⅱ.利用电化学原理,将NO2、O2和熔融KNO3制 成燃料电池,其原理如图3,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅱ是电池的正极,石墨Ⅰ附近发生的反应电极反应式为NO2-e-+NO3-═N2O5相同条件下,消耗的O2和 NO2的体积比为1:4.
分析 Ⅰ.(1)反应焓变=反应物总键能-生成物总键能;
①N2(g)+O2(g)?2NO(g);
②2NO(g)+2CO(g)?2CO2(g)+N2(g);
①+②得:③2CO(g)+O2(g)?2CO2(g),依据反应焓变=反应物总键能-生成物总键能计算该反应的焓变;
依据盖斯定律②=③-①计算2NO(g)+2CO(g)?2CO2(g)+N2(g)△K;
(2)①依据方程式2NO(g)+2CO(g)?2CO2(g)+N2(g),结合图象,列三段,表示出平衡时各物质的物质的量浓度,依据平衡常数表达式解答;
V(N2)=$\frac{△c({N}_{2})}{△t}$ 计算10min内N2平均反应速率;
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,计算此时,反应的浓度商与K比较判断反应进行方向;
③若保持其条件不变,15min时压缩容器至0.5L时,加压平衡逆向移动;
④依据2NO(g)+2CO(g)?2CO2(g)+N2(g)△K<0,可知反应为放热反应,升高温度平衡逆向移动;
Ⅱ.该燃料电池中,负极上通入NO2,正极上通入O2,根据电解质知,负极电极反应式为NO2-e-+NO3-═N2O5,正极电极反应式为O2+2N2O5+4e-═4NO3-,据此分析解答.
解答 解:Ⅰ.(1)反应焓变=反应物总键能-生成物总键能,则③2CO(g)+O2(g)?2CO2(g),△H3=497+2×1072-803×4=-571kJ/mol;
依据盖斯定律:③2CO(g)+O2(g)?2CO2(g)△H3=-571kJ/mol;
①N2(g)+O2(g)?2NO(g)△H=+180kJ/mol;
则③-①得:②2NO(g)+2CO(g)?2CO2(g)+N2(g),则其焓变值△H2=△H3-△H1=-571-180=-751kJ/mol;
故答案为:-751;
(2)①在一定温度下,向体积1L的密闭容器中充入2molNO,10min时反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)达到平衡状态,由图象1可知,平衡时CO物质的量度为0.6mol/L,则:
2NO(g)+2CO(g)?2CO2(g)+N2(g)
起始浓度:mol/L 2 1 0 0
转化浓度:mol/L 0.4 0.4 0.4 0.2
平衡浓度:mol/L 1.6 0.6 0.4 0.2
该反应平衡常数表达式K=$\frac{C{\;}^{2}(C{O}_{2})C({N}_{{\;}_{2}})}{C{\;}^{2}(NO)C{\;}^{2}(CO)}$=$\frac{(0.4)^{2}×0.2}{(1.6)^{2}×(0.6)^{2}}$;
10min内N2平均反应速率v(N2)=$\frac{△c({N}_{2})}{△t}$=$\frac{0.2mol/L}{10min}$=0.02mol/(L•mil);
故答案为:$\frac{(0.4)^{2}×0.2}{(1.6)^{2}×(0.6)^{2}}$;0.02mol/(L•mil);
②若保持温度不变,15min时再向该容器中充入NO1.6mol、CO20.4mol,
则:此时:C(NO)=3.2mol/L;C(CO)=0.6mol/L;C(CO2)=0.8mol/L;C(N2)=0.2mol/L;
反应的浓度商为:$\frac{(0.8){\;}^{2}×0.2}{(3.2){\;}^{2}×(0.6){\;}^{2}}$=$\frac{(0.4)^{2}×0.2}{(1.6)^{2}×(0.6)^{2}}$,说明反应达到平衡,则V正=V逆;
故答案为:=;
③若保持其条件不变,15min时压缩容器至0.5L时反应重新达到平衡,加压平衡逆向移动,一氧化氮浓度增加,依据可逆反应特点,利用极值可知当CO全部反应,则平衡后一氧化氮浓度为3mol/L,所以一氧化氮浓度应介于2mol/L和3mol/L之间,故选B;
故选:B;
④依据2NO(g)+2CO(g)?2CO2(g)+N2(g)△K<0,可知反应为放热反应,升高温度平衡逆向移动,有利于反应逆向进行;
故答案为:NO的分解反应为放热反应,升高温度有利于反应逆向进行;
Ⅱ该燃料电池中,负极上通入NO2,石墨Ⅰ为负极,电极反应式为NO2-e-+NO3-═N2O5,正极上通入O2,石墨Ⅱ为正极,电极反应式为O2+2N2O5+4e-═4NO3-,所以NO3-向负极移动,即NO3-向石墨Ⅰ;
依据O2+2N2O5+4e-═4NO3-,可知1mol氧气得到4mol电子,依据NO2-e-+NO3-═N2O5,1mol二氧化氮失去1mol电子,要使得失电子守恒:则消耗的O2和 NO2的体积比为1:4;
故答案为:正;NO2-e-+NO3-═N2O5;1:4.
点评 本题考查了反应热、反应速率的计算、影响平衡移动的因素,电极反应式的书写,题目综合性强,明确化学平衡移动原理及影响因素、原电池工作原理是解题关键,题目难度中等.

| A. | 有四瓶失去标签的溶液,知道他们是乙醛、乙酸、乙醇和甲酸,用新制的Cu(OH)2悬浊液可以将四种溶液一一鉴别 | |
| B. | 已知苹果酸的结构简式为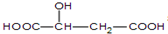 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 | |
| C. | 按系统命名法,化合物 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| D. | 等物质的量的乙炔、乙醛、(HO)CH2-CH2(OH)完全燃烧时的耗氧量不相等 |
| A. | CH3-CH═CH2和CH2═CH2的最简式相同 | |
| B. | 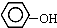 与 与 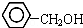 互为同系物 互为同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
| A. | 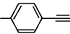 分子中所有原子在同一平面 分子中所有原子在同一平面 | |
| B. | 2,2-二甲基丙烷的核磁共振氢谱有1组峰 | |
| C. | 石油裂解、煤的干馏、玉米制醇、焰色反应都是化学变化 | |
| D. | 将淀粉在酸性条件下水解后直接加入银氨溶液,水浴加热,检验葡萄糖的生成 |
| A. | 可制得14.2g氯气 | B. | 被氧化的HCl的质量为14.6g | ||
| C. | 被氧化的HCl的质量为7.3g | D. | 转移的电子的物质的量为0.2mol |
 .
.