题目内容
已知五种元素的原子序数大小顺序为C>A>B>D>E,A、C同周期,B、C同主族.A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子.式回答下列问题:
(1)用电子式表示离子化合物A2B的形成过程:
(2)写出E和B形成的化合物的结构式: ;写出A、B、E形成的化合物的电子式: .
(3)比较A、B、C三种离子的半径大小 (用离子符号表示).
(1)用电子式表示离子化合物A2B的形成过程:
(2)写出E和B形成的化合物的结构式:
(3)比较A、B、C三种离子的半径大小
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A与B形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30所以每个离子都有10个电子,由化学式的结构可知,B带2个单位负电荷,A带1个单位正电荷,所以A是Na元素,B是O元素,因为A、C同周期,B与C同主族,所以C为S元素,根据题意D和E可形成4核10电子的分子,原子序数B>D>E,可知该分子是NH3,所以D是N元素,E是H元素,据此解答各题即可.
解答:
解:A与B形成离子化合物A2B,A2B中所有粒子的电子数相同,且电子总数为30所以每个离子都有10个电子,由化学式的结构可知,B带2个单位负电荷,A带1个单位正电荷,所以A是Na元素,B是O元素,因为A、C同周期,B与C同主族,所以C为S元素,根据题意D和E可形成4核10电子的分子,原子序数B>D>E,可知该分子是NH3,所以D是N元素,E是H元素,综上所述:A为钠,B为氧,C为硫,D为氮,E为氢,
(1)依据分析可知:A2B是Na2O,由钠离子与氧离子形成的离子化合物,Na2O的形成过程为 .
.
故答案为: ;
;
(2)E与B形成的化合物为H2O或H2O2,结构式分别为H-O-H或H-O-O-H,A、B、E形成的化合物为NaOH,其电子式为: ,故答案为:H-O-H或H-O-O-H;
,故答案为:H-O-H或H-O-O-H; ;
;
(3)元素电子层数越多,半径越大,核外电子排布相同,原子序数越小,半径越大,故S2->O2->Na+,故答案为:S2->O2->Na+.
(1)依据分析可知:A2B是Na2O,由钠离子与氧离子形成的离子化合物,Na2O的形成过程为
 .
.故答案为:
 ;
;(2)E与B形成的化合物为H2O或H2O2,结构式分别为H-O-H或H-O-O-H,A、B、E形成的化合物为NaOH,其电子式为:
 ,故答案为:H-O-H或H-O-O-H;
,故答案为:H-O-H或H-O-O-H; ;
;(3)元素电子层数越多,半径越大,核外电子排布相同,原子序数越小,半径越大,故S2->O2->Na+,故答案为:S2->O2->Na+.
点评:本题以元素推断为载体,考查离子化合物形成过程、电子式书写、离子半径大小比较,难度不大,推断元素是关键,注意掌握电子式的书写.

练习册系列答案
相关题目
用于飞机制造的重要材料是( )
| A、Mg-Al合金 |
| B、Cu-Sn合金 |
| C、Fe-Si合金 |
| D、不锈钢 |
 据物理学家组织网2012年4月16日报道,美国威斯康辛大学米尔沃基分校的科学家发现了一种全新的碳基材料一氧化石墨烯(GMO),其由碳家族的神奇材料石墨烯合成,石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
据物理学家组织网2012年4月16日报道,美国威斯康辛大学米尔沃基分校的科学家发现了一种全新的碳基材料一氧化石墨烯(GMO),其由碳家族的神奇材料石墨烯合成,石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )| A、石墨烯与石墨互为同位素 |
| B、0.12g石墨烯中含有6.02×1022个碳原子 |
| C、石墨烯是一种有机物 |
| D、石墨烯中的碳原子间以共价键结合 |
如图所示与对应的叙述相符的是( )
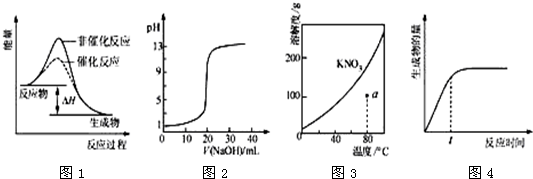

| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1CH3COOH溶液所得到的滴定曲线 |
| C、图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D、图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正>v逆 |
下列化学用语正确的是( )
A、聚丙烯的结构简式: |
B、丙烷分子的比例模型: |
C、四氯化碳的电子式: |
D、3-甲基-1-丁烯分子的键线式: |
下列表示对应化学反应的离子方程式正确的是( )
| A、向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3(胶体)+3H+ |
| B、钠与硫酸铜溶液反应:Cu2++2Na=2Na++Cu |
| C、铁屑溶于过量稀硝酸:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
| D、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
下列各组粒子中,互为同位素的是( )
| A、12H 13H |
| B、O2 O3 |
| C、红磷 白磷 |
| D、57La 58Ce |