题目内容
7.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )| A. | 1 mol甲基(-CH3)所含电子数为9NA | |
| B. | 标准状况下,22.4 L己烷中含氢原子数目为14NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4 L,所含的电子数约为16NA | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
分析 A.甲基中含有9个电子,1mol甲基中含有9mol电子;
B.标准状况下己烷的状态不是气体;
C.B2H6和C2H4分子中都含有16个电子,根据n=$\frac{V}{{V}_{m}}$计算出混合气体的物质的量,然后计算出含有电子的物质的量及数目;
D.二者最简式都是CH,根据最简式计算出该混合物中含有碳原子的物质的量及数目.
解答 解:A.1 mol甲基(-CH3)中含有9mol电子,所含电子数为9NA,故A正确;
B.标况下己烷不是气体,不能使用标况下的气体摩尔体积计算,故B错误;
C.标况下22.4L混合气体的物质的量为1mol,由于B2H6和C2H4分子中都含有16个电子,则1mol该混合气体中所含的电子数为16NA,故C正确;
D.26 g C2H2和苯蒸气的混合气体中含有26g最简式CH,含有最简式CH的物质的量为:$\frac{26g}{13g/mol}$=2mol,则该混合物中含有2molC原子,所含的C原子数为2NA,故D正确;
故选B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
17.为了除去铁粉中的少量铝粉,可以选取下列哪种溶液( )
| A. | 浓盐酸 | B. | 浓硝酸 | C. | 浓硫酸 | D. | 氢氧化钠溶液 |
15.下列有关化学用语能确定为丙烯的是( )
| A. |  | B. | C3H6 | C. |  | D. | CH2═CHCH3 |
2.如图所示,a、b、c、d四个烧杯中都盛有稀硫酸,下列说法正确的是( )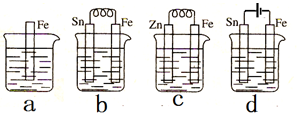

| A. | 装置b中Sn极附近溶液的pH将减小 | |
| B. | 装置c中用锌保护铁的方法称为牺牲阴极的阳极保护法 | |
| C. | 装置d中反应的离子方程式为Fe+2H+$\frac{\underline{\;电解\;}}{\;}$Fe2++H2↑ | |
| D. | 图a、b、c、d中纯铁被腐蚀的速率由快到慢的顺序是b>a>c>d |
19.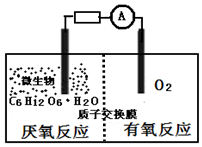 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 负极反应中有CO2生成 | |
| B. | 微生物促进了反应中电子的转移 | |
| C. | 质子通过交换膜从正极区移向负极区 | |
| D. | 电池总反应为C6H12O6+6O2═6CO2+6H2O |
16.若NA代表阿伏加德罗常数,则下列说法中正确的是( )
| A. | 78gNa2O2固体与62gNa2O固体中阴、阳离子总数均为3NA | |
| B. | 在2H2O+2Na2O2=4NaOH+O2↑的反应中,当产生标况下5.6LO2时,转移的电子数为NA | |
| C. | 1mol SiO2分子中含NA个Si原子和2NA个氧原子 | |
| D. | 54g铝与足量的稀硝酸反应产生的氢气分子数为3NA |
17.下列反应属于氧化还原反应且焓变大于0的是( )
| A. | 灼热的炭与水蒸气反应 | B. | Zn和稀H2SO4反应制氢气 | ||
| C. | Ba(OH)2•8H2O和NH4Cl反应 | D. | HCl溶液和NaOH溶液反应 |