题目内容
10.某元素R的单质8.4g,跟足量氧气反应可生成RO2 18.0g,已知元素R原子中所含质子数等于中子数.(1)求R的相对原子质量;
(2)写出R原子的结构示意图.
分析 该元素的单质8.4g与氧气充分反应,生成18.0g的化合物RO2,需要氧气的质量为9.6g,设R的摩尔质量为Mg/mol,则$\frac{8.4g}{Mg/mol}:\frac{9.6g}{16g/mol}=1:2$,所以M=28,根据原子中核外电子数、质子数、质量数、中子数的关系得,R的原子序数=质子数=中子数=14,该元素为Si元素,由此分析解答;
解答 解:该元素的单质8.4g与氧气充分反应,生成18.0g的化合物RO2,需要氧气的质量为9.6g,设R的摩尔质量为Mg/mol,则$\frac{8.4g}{Mg/mol}:\frac{9.6g}{16g/mol}=1:2$,所以M=28,根据原子中核外电子数、质子数、质量数、中子数的关系得,R的原子序数=质子数=中子数=14,该元素为Si元素,
(1)求R的相对原子质量为:14+14=28,答:R的相对原子质量为28;
(2)14号元素硅原子的结构示意图为: ,故答案为:
,故答案为: .
.
点评 本题考查了原子结构和元素性质,涉及原子核外电子排布、质子数和质量数及中子数的关系、元素周期律等知识点,侧重学生对基础知识的考查,题目难度不大.

练习册系列答案
相关题目
18.有关硝酸化学性质的叙述中,正确的是( )
| A. | 浓、稀硝酸都能使蓝色石蕊试纸变红 | |
| B. | 硝酸能与Na2CO3反应,但不生成CO2 | |
| C. | 硝酸与Na2S反应制得H2S | |
| D. | 实验室用棕色试剂瓶保存浓硝酸,且放在阴凉地方 |
3.C、N、O、Al、Si、Cu是常见的六种元素.
(1)Si位于元素周期表第三周期第IVA族.
(2)N的基态原子核外电子排布式为1s22s22p3. Cu的基态原子最外层有1个电子.
(3)用“>”或“<”填空:
(1)Si位于元素周期表第三周期第IVA族.
(2)N的基态原子核外电子排布式为1s22s22p3. Cu的基态原子最外层有1个电子.
(3)用“>”或“<”填空:
| 原子半径 | 电负性 |
| Al>Si | N<O |
10.设NA为阿伏加德罗常数的数值.下列叙述正确的是( )
| A. | 完全氧化56gFe需要消耗氯气33.6 L | |
| B. | 某浓度氢氧化钠溶液恰好溶解5.4g的铝,则被还原的水的分子数为0.6NA | |
| C. | 向100mL 1mol/L的NaHSO3溶液中加入足量的硫酸铁,则反应后氢离子增加0.4mol | |
| D. | 利用铝热反应将磁铁矿还原得到16.8g铁单质,反应中Fe得到了0.9 NA电子 |
7.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列对该溶液的叙述不正确的是( )
| A. | 该温度高于25℃ | |
| B. | 由水电离出来的H+的浓度是1.0×10-12 mol•L-1 | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | c(H+)=c(OH-)+c(SO42-) |

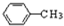 .
. .
.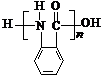 的单体.
的单体.
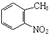 ,试剂a为酸性高锰酸钾溶液.
,试剂a为酸性高锰酸钾溶液.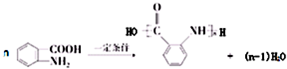 .
.