题目内容
5.常温下,用0.1000mol•L-1 NaOH溶液分别滴定20.00mL 0.1000mol•L-1HBr溶液和20.00mL0.1000mol•L-1 CH3COOH溶液,得到2条滴定曲线,如图所示,下列说法不正确的是( )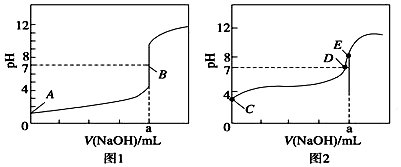
| A. | 根据图1和图2判断,滴定HBr溶液的曲线是图1 | |
| B. | a=20.00 mL | |
| C. | c(Na+)=c(CH3COO-)的点是B点 | |
| D. | E点对应溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
分析 A.HBr是强酸,完全电离,CH3COOH是弱酸,不完全电离,0.1000mol/L的两种酸,滴定起始时,二者pH值不同;
B.NaOH滴定CH3COOH,达到滴定终点时,此时恰好生成CH3COONa,水解使溶液显碱性;
C.根据图1和图2所滴定的具体的酸,结合溶液中的电荷守恒关系;
D.在判断出图2所滴定的酸的类型的基础上,根据溶液中的电荷守恒关系.
解答 解:A.NaOH所滴定的两种酸中,其中HBr是强酸,完全电离,CH3COOH是弱酸,不完全电离,0.1000mol/L的两种酸中,pH值较大的为醋酸,因此图1滴定的是HBr,图2滴定的是醋酸.故A正确;
B.NaOH滴定CH3COOH,达到滴定终点时,此时恰好生成CH3COONa,由于醋酸钠存在水解反应,水解使溶液呈碱性,因此可判断a=20.00mL,二者恰好按照1:1反应进行,故B正确;
C.图1所滴定的酸为HBr,不存在$C{H}_{3}CO{O}^{-}$,因此也不存在$c(N{a}^{+})=c(C{H}_{3}CO{O}^{-})$这一说法.故C错误;
D.E点在图2上,图2所对应的酸是醋酸,NaOH滴定醋酸的过程中,溶液中存在电荷守恒的关系:c(Na+)+c(H+)=c(OH-)+$c(C{H}_{3}CO{O}^{-})$,E点时恰好生成醋酸钠,此由于醋酸钠发生水解,因此$c(N{a}^{+})>c(C{H}_{3}CO{O}^{-})$,此时溶液显碱性,则c(OH-)>c(H+),因此离子浓度顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+).故D正确.
故选C.
点评 本题考查酸碱滴定图象的分析,盐类水解,溶液中pH值判定,离子浓度大小的比较.题目难度不大,牢牢把握守恒思想,是基础题.


请回答下列问题:
则装置的连接顺序(按产物气流从左到右的流向)为④③①②.
II.实验室利用乙烯制备1,2-二溴乙烷的反应原理如图下;CH2=CH2+Br2=BrCH2CH2Br用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图2所示:
①可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚;浓硫酸把乙醇氧化为CO2等.
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78,5 | 132 | 34-6 |
| 熔点/℃ | -130 | 9 | -116 |
(l) A装置上方使用滴液漏斗的优点是:便于漏斗内的液体是顺利滴下
(2)装置C的作用为吸收反应生成的SO2等酸性气体;
(3)实验室制得的1,2-二溴乙烷的产量比理论值低的原因可能是A中的反应温度没有迅速升高到170℃;A中反应温度过高,乙醇被浓硫酸氧化,生成乙烯的量少或A中反应速率过快,导致乙烯的通入速率过快反应不充分;(写两种)
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);依据是1,2-二溴乙烷的密度大于水.
(5)若产物中有少量劃产物乙醚,可用蒸馏的方法除去;
(6)反应过程中应用冷水泠却装置D,若用冰水冷却,则B中的实验现象为玻璃导管的液面会升高,甚至会溢出.
| A. | 非金属元素之间只能形成共价化合物 | |
| B. | 第IA族元素的金属性一定比IIA族元素的金属性强 | |
| C. | 短周期中,同周期元素的离子半径从左到右逐渐减小 | |
| D. | 非金属元素的气态氢化物还原性越强,对应元素的最高价含氧酸酸性越弱 |
| A. | Mg2+的结构示意图: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | H2O2的电子式: | |
| D. | 小苏打的电离方程式:NaHCO3?Na++HCO3- |
| A. | 溴苯中的溴(碘化钾溶液) | B. | 硝基苯中溶有二氧化氮(水) | ||
| C. | 环己烷中的苯(氢气) | D. | 苯中的甲苯(溴水) |
| A. | 氨碱法制碱 | B. | 海带提碘 | C. | 海水提镁 | D. | 海水提溴 |




 主族元素碳、氧、氮、氟、磷、硒及副族元素镍、铜元素在化学中有很重要的地位,回答下列问题:
主族元素碳、氧、氮、氟、磷、硒及副族元素镍、铜元素在化学中有很重要的地位,回答下列问题: .
.