题目内容
15.下列化工生产过程中,未涉及氧化还原反应的是( )| A. | 氨碱法制碱 | B. | 海带提碘 | C. | 海水提镁 | D. | 海水提溴 |
分析 发生的化学反应中,若存在元素的化合价变化,则属于氧化还原反应,以此来解答.
解答 解:A.氨碱法制碱,二氧化碳、氨气、氯化钠反应生成碳酸氢钠和氯化铵,碳酸氢钠受热分解转化为碳酸钠,二氧化碳和水,没有元素的化合价变化,则不涉及氧化还原反应,故A选;
B.海带提碘是由KI变为I2,有元素化合价的变化,属于氧化还原反应,故B不选;
C.从海水中提取镁,电解熔融的MgO时,存在元素的化合价变化,为氧化还原反应,故C不选;
D.海水提溴是由溴元素的化合物变为溴元素的单质,有元素化合价的变化,属于氧化还原反应,故D不选.
故选A.
点评 本题考查氧化还原反应,为高频考点,侧重考查于化学与生活、生产的考查,有利于培养学生良好的科学素养,把握发生的化学反应及反应中元素的化合价变化为解答的关键,注意从元素化合价变化角度分析,题目难度不大.

练习册系列答案
相关题目
5.常温下,用0.1000mol•L-1 NaOH溶液分别滴定20.00mL 0.1000mol•L-1HBr溶液和20.00mL0.1000mol•L-1 CH3COOH溶液,得到2条滴定曲线,如图所示,下列说法不正确的是( )
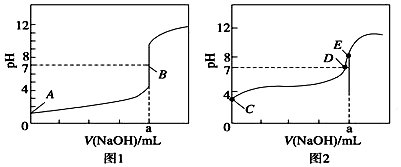

| A. | 根据图1和图2判断,滴定HBr溶液的曲线是图1 | |
| B. | a=20.00 mL | |
| C. | c(Na+)=c(CH3COO-)的点是B点 | |
| D. | E点对应溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
6.将15g CH4和 C2H4 的混合气体通入盛有足量溴水的容器中,溴水的质量增加了7g,则混合气体中CH4和 C2H4的体积比为( )
| A. | 1:2 | B. | 1:3 | C. | 2:1 | D. | 2:3 |
3.下列各组离子在溶液中按括号内的物质的量之比混合,不能得到无色、碱性、澄清溶液 的是( )
| A. | Na+、Al3+、Cl-、OH- (5:1:4:4) | B. | NH4+、Ba2+、OH-、Cl-(1:1:1:2) | ||
| C. | Ag+、NH4+、OH-、NO3-(1:3:3:1) | D. | K+、H+、I-、HCO3-(2:1:2:1) |
10. “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 分子中所有的原子共面 | |
| B. | 1molEGC与4molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 遇FeCl3溶液不能发生显色反应 |
20.下列除杂过程中,所选用的试剂或方法不正确的是( )
| A. | Fe2O3固体中混有A12O3:加入足量的盐酸,过滤 | |
| B. | SO2气体中混有HC1:通过饱和亚硫酸氢钠溶液 | |
| C. | FeCl2溶液中混有FeCl3:加入过量的铁粉,过滤 | |
| D. | KNO3固体中混有少量的NaCl:热水溶解、降温结晶、过滤 |
7.用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )


| A. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 | |
| B. | 实验仪器D可以起到防止溶液倒吸的作用 | |
| C. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 | |
| D. | 若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中无明显现象 |
4. 可知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,如图中曲线b代表一定条件下该反应的进程.若使曲线b变为曲线a,可采取的措施是( )
可知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,如图中曲线b代表一定条件下该反应的进程.若使曲线b变为曲线a,可采取的措施是( )
①增大A的浓度;②缩小容器的容积;③增大B的浓度;④升高温度;⑤加入合适的催化剂.
 可知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,如图中曲线b代表一定条件下该反应的进程.若使曲线b变为曲线a,可采取的措施是( )
可知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,如图中曲线b代表一定条件下该反应的进程.若使曲线b变为曲线a,可采取的措施是( )①增大A的浓度;②缩小容器的容积;③增大B的浓度;④升高温度;⑤加入合适的催化剂.
| A. | ⑤ | B. | ②④ | C. | ②⑤ | D. | ②③ |
6.设NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 室温时,1.0L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA | |
| B. | 标准状况下,11.2L CH2Cl2中含有的原子数为2.5NA | |
| C. | 1.68g Fe 与足量高温水蒸气反应,转移电子数为0.09NA | |
| D. | 17g H2O2所含非极性键数目为0.5NA |