题目内容
17.甲酸及其盐具有强还原性,能发生银镜反应,甲酸是唯一能和烯烃发生加 成反应的羧酸,25℃时甲酸的电离常数为2.1×10-4.
(1)利用光催化制甲酸原理如图一1所示:
①该装置能量转化方式为光能转化为化学能和电能.②电极a上发生的电极反应式为CO2+2H++2e-=HCOOH.
(2)另一种制取甲酸的机理如图2所示,Ru(OH)2在反应中的作用为催化剂,该制备反应的化学方程式为CO2+H2 $\frac{\underline{\;R(OH)_{2}\;}}{\;}$HCOOH.
(3)甲酸也可由甲醇氧化制取.在催化剂作用下,C0可用于合成甲醇:CO(g)+2H2 (g)═CH30H(g).在恒温条件下,向2L的密闭定容容器中充入1mol CO和2molH2合成甲醇.
①判断达到平衡状态的标志是ac(填字母).
a.CO体积分数保持不变
b.CO和CH3OH浓度相等
c.容器中气体的压强不变
d.CH3OH的生成速率与CO消耗速率相等
e.容器中混合气体的密度保持不变
②经过5min达到平衡,此时CO的转化率为50%,则从开始到平衡,H2的平均反应速率为0.1mol/(L•min);平衡后保持原条件不变,再向容器中加入1mol CH3OH(g),平衡向逆向(填“正向”或“逆向”)移动.达新平衡后CO体积分数与原平衡相比减小(填“增大”或“减小”).
(4)甲酸常温下可与银氨溶液发生银镜反应,同时有NH4HCO3生成,该反应的离子方程式为HCOOH+2Ag(NH3)2++2OH-→2Ag↓+HCO3-+NH4++3NH3+H2O.
(5)25℃甲酸与醋酸钠溶液反应:HCOOH+CH3COO-=HCOO-+CH3COOH2,该反应的平衡常数为12,则该温度下醋酸的电离常为:K.(CH3COOH)=1.75×10-5.
分析 (1)①该装置能量转化方式为光能转化为化学能和电能;
②电极a上发生还原反应,其电极反应为CO2+2H++2e-=HCOOH;
(2)由图2可知,Ru(OH)2在反应中的作用为催化剂,反应的化学方程式为:CO2+H2$\frac{\underline{\;R(OH)_{2}\;}}{\;}$HCOOH;
(3)①根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
②经过5min达到平衡,此时CO的转化率为50%,结合化学平衡三行计算列式计算得到反应速率,平衡后保持原条件不变,再向容器中加入1mol CH3OH(g),平衡逆向进行,
(4)甲酸与丙烯加成生成甲酸酯,主要产物的结构简式为HCOOCH(CH3)2;甲酸常温下可与银氨溶液发生银镜反应,同时有(NH4HCO3生成,该反应的离子方程式为HCOOH+2Ag(NH3)2++2OH-→2Ag↓+HCO3-+NH4++3NH3+H2O;
(5)25℃甲酸与醋酸钠溶液反应:HCOOH+CH3COO-?HCOO-+CH3COOH,该反应的平衡常数为12,即$\frac{c(C{H}_{3}COOH)c(HCO{O}^{-})}{c(HCOOH)c(C{H}_{3}CO{O}^{-})}$=$\frac{Ka(HCOOH)}{Ka(C{H}_{3}COOH)}$12;
解答 解:(1)①该装置能量转化方式为光能转化为化学能和电能,
故答案为:光能转化为化学能和电能;
②电极a上发生还原反应,其电极反应为CO2+2H++2e-=HCOOH,
故答案为:CO2+2H++2e-=HCOOH;
(2)由图2可知,Ru(OH)2在反应中的作用为催化剂,反应的化学方程式为:CO2+H2$\frac{\underline{\;R(OH)_{2}\;}}{\;}$HCOOH,
故答案为:催化剂;CO2+H2$\frac{\underline{\;R(OH)_{2}\;}}{\;}$HCOOH;
(3)CO(g)+2H2 (g)═CH3OH(g).
①a.CO体积分数保持不变是平衡标志,故a正确;
b.CO和CH3OH浓度相等不能说明正逆反应速率相同,故b错误;
c.反应前后气体物质的量变化,容器中气体的压强不变说明反应达到平衡状态,故c正确;
d.CH3OH的生成速率与CO消耗速率相等,说明反应正向进行,不能说明反应达到平衡状态,故d错误;
e.反应前后气体质量和体积不变,容器中混合气体的密度始终保持不变,不能说明反应达到平衡状态,故e错误;
故答案为:ac;
②在恒温条件下,向2L的密闭定容容器中充入1mol CO和2molH2合成甲醇,经过5min达到平衡,此时CO的转化率为50%,
CO(g)+2H2 (g)═CH3OH(g).
起始量(mol) 1 2 0
变化量(mol) 0.5 1 0.5
平衡量(mol) 0.5 1 0.5
则从开始到平衡,H2的平均反应速率=$\frac{\frac{1mol}{2L}}{5min}$=0.1mol/(L•min),
平衡后保持原条件不变,再向容器中加入1mol CH3OH(g),平衡向逆向进行,加入1mol甲醇和通入1mol一氧化碳、2mol氢气达到相同平衡状态,所以加入1mol甲醇相当于给平衡体系增大压强,一氧化碳转化率增大,达新平衡后CO体积分数与原平衡相比减小
故答案为:0.1mol/(L•min);逆向;减小;
(4)甲酸与丙烯加成生成甲酸酯,主要产物的结构简式为HCOOCH(CH3)2;甲酸常温下可与银氨溶液发生银镜反应,同时有(NH4HCO3生成,该反应的离子方程式为:HCOOH+2Ag(NH3)2++2OH-→2Ag↓+HCO3-+NH4++3NH3+H2O,
故答案为:HCOOH+2Ag(NH3)2++2OH-→2Ag↓+HCO3-+NH4++3NH3+H2O;
(5)25℃甲酸与醋酸钠溶液反应:HCOOH+CH3COO-?HCOO-+CH3COOH,该反应的平衡常数为12,即$\frac{c(C{H}_{3}COOH)c(HCO{O}^{-})}{c(HCOOH)c(C{H}_{3}CO{O}^{-})}$=$\frac{Ka(HCOOH)}{Ka(C{H}_{3}COOH)}$=12,也就是:$\frac{2.1×1{0}^{-4}}{Ka}$=12,则该温度下醋酸的电离常数为:Ka(CH3COOH)=1.75×10-5,
故答案为:1.75×10-5.
点评 本题比较综合,涉及电化学、平衡常数影响因素及应用、氧化还原反应计算、电极反应式书写、电离平衡常数应用等,需要学生具备扎实的基础,题目难度中等.

 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)═BaS(s)+4CO(g)△H=+571.2kJ•mol-1
BaS(s)═Ba(s)+S(s)△H=+460kJ•mol-1
已知:O2(g)+2C(s)═2CO(g)△H=-221kJ•mol-1,
请写出O2(g)氧化Ba(s)和S(s)生成1molBaSO4(s)的热化学方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=-1473.2kJ/mol.
(2)二氧化硫在一定条件下还可以发生如下反应:SO2 (g)+NO2(g)?SO3(g)+NO (g)△H=-42kJ•mol-1.在1L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如表:
| 实验 编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(SO2) | n(NO2) | n(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T2 | 0.20 | 0.30 | a |
②实验丙中,达到平衡时,NO2的转化率为40%;a=0.12
③由表中数据可推知,T1<T2(填“>”“<”或“=”),判断的理由是T1时,该反应的平衡常数K1=2.6,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2 .
(3)甲烷在熔融固体氧化物中形成的燃料电池,其工作原理如图所示.
a是电池的正极(填“正”或“负”),b极的电极反应式为CH4+4O2--8e-=CO2+2H2O.
| A. | CH4分子的比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 原子核内有10个中子的氧原子:18O | D. | CO2的填充模型: |
| A. | 充电时,反应每生成1mol H+时电子转移的物质的量为1mol | |
| B. | 放电过程中,正极附近溶液的酸性减弱 | |
| C. | 放电时,正极反应为VO2++2H++e-═VO2++H2O | |
| D. | 充电时,阴极附近溶液由紫色逐渐变为绿色 |
| A. | M3O4、MO 1:1 | B. | MO2、MO 3:1 | C. | M3O4、MO2 2:1 | D. | MO2、MO 1:4 |
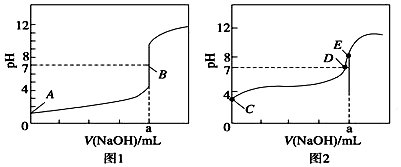
| A. | 根据图1和图2判断,滴定HBr溶液的曲线是图1 | |
| B. | a=20.00 mL | |
| C. | c(Na+)=c(CH3COO-)的点是B点 | |
| D. | E点对应溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| A. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| B. | 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 | |
| C. | 二氧化锰具有氧化性,既能氧化浓盐酸制氯气,也能将双氧水氧化为氧气 | |
| D. | 氮的氧化物是形成光化学烟雾的主要物质 |
 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.下列说法中正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.下列说法中正确的是( )| A. | 该物质分子式为C17H20O4 | |
| B. | 该物质可以发生氧化反应、酯化反应和消去反应 | |
| C. | 1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol | |
| D. | 该物质有酸性,1mol该物质与NaOH反应时最多消耗NaOH为3mol |
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 分子中所有的原子共面 | |
| B. | 1molEGC与4molNaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 遇FeCl3溶液不能发生显色反应 |