题目内容
13.I.实验室制乙烯的反应原理为CH3CH2OH$→_{170°C}^{浓H_{2}SO_{4}}$CH=CH2↑+C2H,制得的乙烯中往往混有CO2、SO2和水蒸气,现拟图1装置设计一个实验,以验证乙烯中所含杂质气体的成份.
请回答下列问题:
则装置的连接顺序(按产物气流从左到右的流向)为④③①②.
II.实验室利用乙烯制备1,2-二溴乙烷的反应原理如图下;CH2=CH2+Br2=BrCH2CH2Br用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图2所示:
①可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚;浓硫酸把乙醇氧化为CO2等.
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78,5 | 132 | 34-6 |
| 熔点/℃ | -130 | 9 | -116 |
(l) A装置上方使用滴液漏斗的优点是:便于漏斗内的液体是顺利滴下
(2)装置C的作用为吸收反应生成的SO2等酸性气体;
(3)实验室制得的1,2-二溴乙烷的产量比理论值低的原因可能是A中的反应温度没有迅速升高到170℃;A中反应温度过高,乙醇被浓硫酸氧化,生成乙烯的量少或A中反应速率过快,导致乙烯的通入速率过快反应不充分;(写两种)
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);依据是1,2-二溴乙烷的密度大于水.
(5)若产物中有少量劃产物乙醚,可用蒸馏的方法除去;
(6)反应过程中应用冷水泠却装置D,若用冰水冷却,则B中的实验现象为玻璃导管的液面会升高,甚至会溢出.
分析 I、检验二氧化硫用品红溶液,检验二氧化碳用澄清的石灰水,检验水蒸气用无水硫酸铜,因溶液中有水,所以首先检验水蒸气;因为CO2是用澄清石灰水来检验的,而SO2也可以使澄清石灰水变浑,二氧化硫能使品红褪色,二氧化碳不能,所以,检验二氧化硫在检验二氧化碳之前,再通过澄清石灰水确认CO2存在;
Ⅱ、装置A是乙醇在浓硫酸的存在下在170℃脱水生成乙烯,浓硫酸的强氧化性、脱水性导致市场的乙烯气体中含有杂质二氧化硫、二氧化碳、水蒸气等杂质,通过装置B中长导管内液面上升或下降调节装置内压强,B为安全瓶,可以防止倒吸,根据E中内外液面高低变化,可以判断是否发生堵塞,二氧化碳、二氧化硫能和氢氧化钠溶液反应,装置C是利用氢氧化钠溶液吸收杂质气体,溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,装置D冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,否则会使产品凝固而堵塞导管,1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,所以加水,振荡后静置,产物应在下层,分离得到产品,以此解答该题,
(1)滴液漏斗平衡压强,便于液体流下;
(2)生成的酸性气体为SO2、CO2可以和氢氧化钠反应;
(3)A中的反应温度没有迅速升高到170℃;A中反应温度过高,乙醇被浓硫酸氧化,生成乙烯的量少;A中反应速率过快,导致乙烯的通入速率过快反应不充分;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;
(6)1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞;
解答 解:I、乙醇跟浓H2SO4温度过高反应,CH3CH2OH+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2↑+CO2↑+7H2O+C,选用装置④;因溶液中有水,所以必须先检验水蒸气,选用装置③,放入无水硫酸铜,变蓝则说明有水生成;因二氧化碳和二氧化硫都能使澄清的石灰水变浑浊,二氧化硫能使品红褪色,二氧化碳不能,所以用装置①,A装置品红褪色,则说明有SO2气体产生,B装置吸收SO2,C装置品红不褪色,说明吸收完全;最后用装置②,通过澄清石灰水变浑浊,确认CO2存在,
故答案为:④③①②;
II、(1)A装置上方使用滴液漏斗的优点是便于漏斗内的液体是顺利滴下,
故答案为:;便于漏斗内的液体是顺利滴下
(2)在装置C中应加入氢氧化钠溶液,其目的是吸收反应生成的SO2等酸性气体,因为SO2能被溴氧化,
故答案为:吸收反应生成的SO2等酸性气体;
(3)实验室制得的1,2-二溴乙烷的产量比理论值低的原因可能是A中的反应温度没有迅速升高到170℃;A中反应温度过高,乙醇被浓硫酸氧化,生成乙烯的量少;A中反应速率过快,导致乙烯的通入速率过快反应不充分等,
故答案为:A中的反应温度没有迅速升高到170℃;A中反应温度过高,乙醇被浓硫酸氧化,生成乙烯的量少;A中反应速率过快,导致乙烯的通入速率过快反应不充分;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,1,2-二溴乙烷的密度大于水,比水重在水溶液下层,
故答案为:下; 1,2-二溴乙烷的密度大于水;
(5)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;
故答案为:蒸馏;
(6)反应过程中应用冷水泠却装置D,若用冰水冷却,溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,过度冷却会使其凝固而使气路堵塞,导致B中长导管内液面上升,则B中的实验现象为:玻璃导管的液面会升高,甚至会溢出,
故答案为:玻璃导管的液面会升高,甚至会溢出;
点评 本题考查有机物合成实验,为高考常见题型,涉及制备原理、物质的分离提纯、实验条件控制、对操作分析评价等,是对基础知识的综合考查,需要学生具备扎实的基础,题目难度中等.

| A. | 0.05 mol/(L•s) | B. | 0.10 mol/(L•s) | C. | 0.15 mol/(L•s) | D. | 2.0 mol/(L•s) |
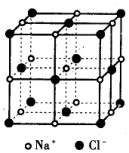 已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )| A. | 117α3ρ | B. | $\frac{M}{N{α}^{3}}$ | C. | $\frac{234}{{α}^{3}ρ}$ | D. | $\frac{58.5}{2{α}^{3}ρ}$ |
| A. | 1 mol Al3+含有的核外电子数为3NA | |
| B. | 将5.85 g NaCl溶于100g水中,所得NaCl溶液的浓度为1.00mol•L-1 | |
| C. | 1 mol Cl2与足量的铁反应,转移的电子数为2NA | |
| D. | 常温下,pH=1的硫酸溶液中含有的H+数为NA |
| A. | CH4分子的比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 原子核内有10个中子的氧原子:18O | D. | CO2的填充模型: |
 实验室现有一瓶标签右半部分已被腐蚀的固体M,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行下列有关实验,其中说法正确的是( )
实验室现有一瓶标签右半部分已被腐蚀的固体M,剩余部分只看到“Na2S”字样(如图所示).已知固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行下列有关实验,其中说法正确的是( )| A. | 往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3 | |
| B. | 往溶液中加入稀盐酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4 | |
| C. | 用pH试纸检验,若pH=7,则固体M不一定是Na2SO4 | |
| D. | 只用盐酸一种试剂不能确定该固体M的具体成分 |
| A. | 充电时,反应每生成1mol H+时电子转移的物质的量为1mol | |
| B. | 放电过程中,正极附近溶液的酸性减弱 | |
| C. | 放电时,正极反应为VO2++2H++e-═VO2++H2O | |
| D. | 充电时,阴极附近溶液由紫色逐渐变为绿色 |

| A. | 根据图1和图2判断,滴定HBr溶液的曲线是图1 | |
| B. | a=20.00 mL | |
| C. | c(Na+)=c(CH3COO-)的点是B点 | |
| D. | E点对应溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| A. | 1:2 | B. | 1:3 | C. | 2:1 | D. | 2:3 |