题目内容
12.在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2的化合物是( )| A. |  | B. |  | ||
| C. |  | D. | 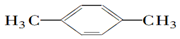 |
分析 核磁共振氢谱中出现两组峰,则分子中含2种H,结合氢原子数之比为3:2来解答.
解答 解:A.含2种H,H原子数比为6:2=3:1,故A不选;
B.含3种H,H原子数比为6:2:2=3:1:1,故B不选;
C.含3种H,H原子数比为6:2:8=3:1:4,故C不选;
D.分子中含2种H,氢原子数之比为6:4=3:2,故D选;
故选D.
点评 本题考查有机物的结构,为高频考点,把握有机物结构的对称性、H原子的种类及数目为解答的关键,侧重分析与应用能力的考查,注意核磁共振氢谱的应用,题目难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
20.大海是一个资源宝库,从海水中提取镁和溴的实验如下:
Ⅰ.(1)海水提镁的步骤如下,请在横线上将实验步骤、目的补充完整.
(2)结合以上实验步骤,列举一个能与海水提镁相联合的工业生产实例制备盐酸.
Ⅱ.已知海水中溴元素主要以Br-形式存在,工业上从海水中提取溴的流程如下:

(1)吸收塔1中发生反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
(2)吸收塔2中发生反应:3Br2+3Na2CO3=NaBrO3+3CO2+5NaBr.当3mol Br2完全反应时转移电子5mol.
(3)吸收塔3中反应的离子方程式为5Br-+BrO3-+6H+=Br2+3H2O.
(4)吹出塔、吸收塔2的作用分别是用热空气把生成的溴单质吹出,富集溴.
Ⅰ.(1)海水提镁的步骤如下,请在横线上将实验步骤、目的补充完整.
| 实验步骤 | 实验目的 |
| ①将贝壳煅烧后制成石灰乳. | |
| ②将海水进行浓缩. | |
| ③加入石灰乳沉淀过滤. | 沉淀镁离子生成氢氧化镁沉淀 |
| ④向步骤③所得物质中加入稀盐酸,将溶液进行蒸发浓缩、结晶、过滤. | |
| ⑤将得到的产物干燥除水后,MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑(填化学方程式)得到金属镁. |
Ⅱ.已知海水中溴元素主要以Br-形式存在,工业上从海水中提取溴的流程如下:

(1)吸收塔1中发生反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
(2)吸收塔2中发生反应:3Br2+3Na2CO3=NaBrO3+3CO2+5NaBr.当3mol Br2完全反应时转移电子5mol.
(3)吸收塔3中反应的离子方程式为5Br-+BrO3-+6H+=Br2+3H2O.
(4)吹出塔、吸收塔2的作用分别是用热空气把生成的溴单质吹出,富集溴.
1.某化学反应的反应物浓度在20s内由3.0mol/L变为1.0mol/L,则以该反应物浓度的变化表示20s内的平均反应速率为( )
| A. | 0.05 mol/(L•s) | B. | 0.10 mol/(L•s) | C. | 0.15 mol/(L•s) | D. | 2.0 mol/(L•s) |
18.下列理论解释和结论都正确的是( )
| 选项 | 理论解释 | 结论 |
| A | H-N的键能大于H-P | 沸点:NH3>PH3 |
| B | 离子半径:Mg2+<Ba2+ | 热分解温度:碳酸镁髙于碳酸钡 |
| C | 离子半径:Na+<Cs+ | 配位数(C.N.):NaCl<CsCl |
| D | 晶格能:FeS2>ZnS | 岩浆中的硫化物矿物析出顺序ZnS先于FeS2 |
| A. | A | B. | B | C. | C | D. | D |
7. 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.
(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)═BaS(s)+4CO(g)△H=+571.2kJ•mol-1
BaS(s)═Ba(s)+S(s)△H=+460kJ•mol-1
已知:O2(g)+2C(s)═2CO(g)△H=-221kJ•mol-1,
请写出O2(g)氧化Ba(s)和S(s)生成1molBaSO4(s)的热化学方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=-1473.2kJ/mol.
(2)二氧化硫在一定条件下还可以发生如下反应:SO2 (g)+NO2(g)?SO3(g)+NO (g)△H=-42kJ•mol-1.在1L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如表:
①实验甲中,若2min 时测得放出的热量是4.2kJ,则0→2min时间内,用SO2(g)表示的平均反应速率υ(SO2)=0.05mol/(L•min)
②实验丙中,达到平衡时,NO2的转化率为40%;a=0.12
③由表中数据可推知,T1<T2(填“>”“<”或“=”),判断的理由是T1时,该反应的平衡常数K1=2.6,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2 .
(3)甲烷在熔融固体氧化物中形成的燃料电池,其工作原理如图所示.
a是电池的正极(填“正”或“负”),b极的电极反应式为CH4+4O2--8e-=CO2+2H2O.
 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)═BaS(s)+4CO(g)△H=+571.2kJ•mol-1
BaS(s)═Ba(s)+S(s)△H=+460kJ•mol-1
已知:O2(g)+2C(s)═2CO(g)△H=-221kJ•mol-1,
请写出O2(g)氧化Ba(s)和S(s)生成1molBaSO4(s)的热化学方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=-1473.2kJ/mol.
(2)二氧化硫在一定条件下还可以发生如下反应:SO2 (g)+NO2(g)?SO3(g)+NO (g)△H=-42kJ•mol-1.在1L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如表:
| 实验 编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(SO2) | n(NO2) | n(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T2 | 0.20 | 0.30 | a |
②实验丙中,达到平衡时,NO2的转化率为40%;a=0.12
③由表中数据可推知,T1<T2(填“>”“<”或“=”),判断的理由是T1时,该反应的平衡常数K1=2.6,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2 .
(3)甲烷在熔融固体氧化物中形成的燃料电池,其工作原理如图所示.
a是电池的正极(填“正”或“负”),b极的电极反应式为CH4+4O2--8e-=CO2+2H2O.
4.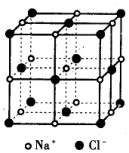 已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )
 已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为58.5g•mol-1,食盐晶体的密度为ρg•cm-3,若图中Na+与最邻近的Cl-的核间距离为a cm,那么阿伏加德罗常数的值可表示为( )| A. | 117α3ρ | B. | $\frac{M}{N{α}^{3}}$ | C. | $\frac{234}{{α}^{3}ρ}$ | D. | $\frac{58.5}{2{α}^{3}ρ}$ |
1.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol Al3+含有的核外电子数为3NA | |
| B. | 将5.85 g NaCl溶于100g水中,所得NaCl溶液的浓度为1.00mol•L-1 | |
| C. | 1 mol Cl2与足量的铁反应,转移的电子数为2NA | |
| D. | 常温下,pH=1的硫酸溶液中含有的H+数为NA |
5.常温下,用0.1000mol•L-1 NaOH溶液分别滴定20.00mL 0.1000mol•L-1HBr溶液和20.00mL0.1000mol•L-1 CH3COOH溶液,得到2条滴定曲线,如图所示,下列说法不正确的是( )
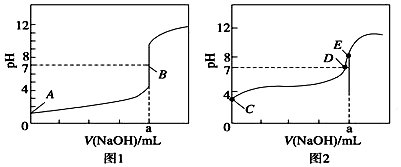

| A. | 根据图1和图2判断,滴定HBr溶液的曲线是图1 | |
| B. | a=20.00 mL | |
| C. | c(Na+)=c(CH3COO-)的点是B点 | |
| D. | E点对应溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |