题目内容
8.常温下,取铝土矿(含有Al2O3、FeO、Fe2O3、SiO2等物质)用硫酸浸出后的溶液,分别向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )| A. | 加入过量NaOH溶液:Na+、AlO2-、OH-、SO42- | |
| B. | 加入过量氨水:NH4+、Al3+、OH-、SO42- | |
| C. | 通入过量SO2:Fe2+、H+、SO32-、SO42- | |
| D. | 加入过量NaClO溶液:Fe2+、Na+、ClO-、SO42- |
分析 加入过量硫酸溶解后过滤,SiO2不反应,则滤液中含有的离子为:Fe3+、Fe2+、Al3+、SO42-、H+,
A.加入过滤氢氧化钠溶液,生成氢氧化铁沉淀,Al3+生成AlO2-;
B.加入氨水,可生成氢氧化铝沉淀;
C.通入过量SO2,与铝离子不反应;
D.NaClO具有强氧化性.
解答 解:加入过量硫酸溶解后过滤,SiO2不反应,则滤液中含有的离子为:Fe3+、Fe2+、Al3+、SO42-、H+,
A.加入过滤氢氧化钠溶液,生成氢氧化铁沉淀,Al3+生成AlO2-,故A正确;
B.加入氨水,可生成氢氧化铝沉淀,溶液不存在Al3+,故B错误;
C.通入过量SO2,与铝离子不反应,溶液中还存在Al3+,故C错误;
D.NaClO具有强氧化性,与Fe2+不能大量共存,故D错误.
故选A.
点评 本题考查离子共存,为高考的高频题,题目难度中等,明确滤液组成为解答关键,试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案
相关题目
4.分析图中各项的排布规律,请推测第10列有机物的分子式为( )


| A. | C50H80 | B. | C50H82 | C. | C50H84 | D. | C50H86 |
19.下列冇关实验方法或操作正确的( )
| A. |  喷泉实验 | B. |  氯气除杂 氯气除杂 | C. |  分离汽油和水 | D. |  丁达尔效应 |
3.高温条件下,Al和Fe2O3反应生成Fe和Al2O3.下列说法正确的是( )
| A. |  该反应过程中的能量变化如图所示 | |
| B. | 该反应条件下,Al的还原性强于Fe | |
| C. | 反应中每生成1 mol Fe转移6×6.02×1023个电子 | |
| D. | 实验室进行该反应时常加入KClO3作催化剂 |
13.实验室用下列装置从NaBr溶液中制备单质溴,其合理的是( )
| A. | 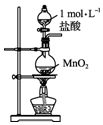 用装置甲制取氯气 | B. | 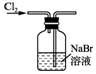 用装置乙氧化溴离子 | ||
| C. | 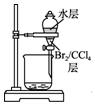 用装置丙分离出溴的CCl4溶液 | D. | 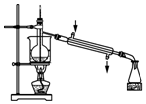 用装置丁获得单质溴 |
20.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| C. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
17.下列指定反应的离子方程式书写正确的是( )
| A. | 少量SO2 通入漂白粉溶液中:SO2+H2O+Ca2++3C1O-═CaSO4↓+2HC1O+Cl- | |
| B. | 石灰水与过量小苏打溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | FeCl2溶液中通入 C12:Fe2++Cl2═Fe3++2Cl- | |
| D. | NaAlO2 溶液中通入过量CO2:AlO2-+4CO2+2H2O═A13++4HCO3- |
18.在一定体积的1L密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
下列说法正确的是( )
| t/℃ | 700 | 800 | 830 | 1 000 |
| K | 0.6 | 0.9 | 1.0 | 1.7 |
| A. | 上述生成CO和H2O的反应为放热反应 | |
| B. | 加压、增大H2浓度和加入催化剂都能提高CO2的转化率 | |
| C. | 830℃达平衡后,再充入1.0 mol H2,K值增大,平衡正向移动 | |
| D. | 830℃时反应CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数为1 |
 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空: