题目内容
11.下列说法正确的是( )| A. | 稀醋酸中加入少量醋酸钠固体能增大醋酸的电离程度 | |
| B. | 室温下,氨水加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| C. | NaHCO3溶液中溶质的电离方程式为NaHCO3=Na++H++CO32- | |
| D. | 强电解质溶液导电能力不一定强于弱电解质溶液 |
分析 A.醋酸钠溶解醋酸根离子浓度增大抑制醋酸的电离;
B.加水稀释促进一水合氨电离,但铵根离子和氢氧根离子浓度都减小;
C.碳酸氢根离子是弱酸阴离子不能完全电离;
D.强电解质溶液导电能力不一定强于弱电解质,导电能力由离子浓度大小决定.
解答 解:A.稀醋酸中加入少量醋酸钠固体,溶解醋酸根离子浓度增大抑制醋酸的电离,能减少醋酸的电离程度,故A错误;
B.加水稀释促进一水合氨电离,但铵根离子和氢氧根离子浓度都减小,所以c(NH4+)•c(OH-)变小,故B错误;
C.NaHCO3溶液中溶质的电离方程式为:NaHCO3=Na++HCO3-,故C错误;
D.强电解质溶液导电能力不一定强于弱电解质,导电能力由离子浓度大小决定,如硫酸钡是强电解质水溶液中导电能力弱于弱电解质醋酸溶液的导电能力,故D正确;
故选D.
点评 本题考查了弱电解质电离平衡、影响因素分析判断、注意溶液导电能力和离子浓度有关,题目难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
1.下列各组离子在指定条件的水溶液中能大量共存的是( )
| A. | 使石蕊变红色溶液:Ca2+、K+、HCO3-、Cl- | |
| B. | 强碱性的无色溶液:Na+、Ba2+、OH-、Cl- | |
| C. | PH=7的无色溶液:NH4+、Mg2+、MnO4-、HCO3- | |
| D. | 加锌能产生氢气的溶液:H+、Cu2+、CO32-、NO3- |
2.关于0.1mol•L-1NaHCO3溶液,下列说法正确的是( )
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) | |
| D. | 微粒浓度关系:c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] |
19.聚苯乙烯塑料在生产、生活中有广泛应用,其单体苯乙烯可由乙苯和二氧化碳在一定条件下发生如下反应制取: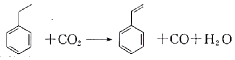
下列有关苯乙烯的说法正确的是( )

下列有关苯乙烯的说法正确的是( )
| A. | 分子中含有4个碳碳双键 | B. | 属于不含极性键的共价化合物 | ||
| C. | 分子式为C8H10 | D. | 通过加聚反应生成聚苯乙烯 |
6.表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 碳酸钠溶液可用于治疗胃病 | Na2CO3可与盐酸反应 | Ⅰ对,Ⅱ对,有 |
| B | 向Na2O2的水溶液中滴入酚酞变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾能力强的黄光 | Ⅰ对,Ⅱ对,有 |
| D | 过氧化钠可为航天员供氧 | Na2O2能与CO2和H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
16.氯水中存在多种分子和离子,可通过实验的方法加以确定.下列说法错误的是( )
| A. | 氯水呈浅黄色,且有刺激性气味,说明有Cl2分子存在 | |
| B. | 加入有色布条后,有色布条褪色,说明有HClO分子存在 | |
| C. | 加入含有NaOH的酚酞试液,红色褪去,说明有H+离子存在 | |
| D. | 加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-离子存在 |
1.在浓度均为1mol•L-1的(NH4)2SO4和NH4Cl两种溶液中,NH4+的水解程度分别为a1,a2,NH4+的浓度分别为c1,c2,则( )
| A. | a1>a2,c1>c2 | B. | a1<a2,c1<c2 | C. | a1>a2,c1<c2 | D. | a1<a2,c1>c2 |
