题目内容
某溶液中只含有K+、Na+、NO3-、SO42-四种离子(不考虑水的电离)它们的物质的量之比为1:6:3:2,该溶液所含的溶质可能是( )
| A、KNO3、Na2SO4 |
| B、K2SO4、NaNO3、KNO3 |
| C、KNO3、Na2SO4、NaNO3 |
| D、K2SO4、Na2SO4、KNO3 |
考点:离子反应发生的条件,物质的量的相关计算,溶液的组成
专题:计算题
分析:溶液中所有阳离子带的正电荷总数等于所有阴离子带的负电荷总数,溶液不显电性.根据四种离子数目比为1:6:3:2分析解答.
解答:
解:A、不可能只含KNO3、Na2SO4,与K+、NO3-的物质的量之比为1:3不符,故A错误;
B、若为K2SO4、NaNO3、KNO3,无论三种物质以何种比例混合,钾离子和硫酸根离子的个数比都大于1:2,与信息不符,故B错误;
C、若为KNO3、NaNO3、Na2SO4,以1:2:2的比例混合时离子数目比符合题意,故C正确;
D、若为K2SO4、Na2SO4、KNO3,Na+与SO42-的比例为6:3,应恰好消耗没,故不存在K2SO4,故D错误;
故选C.
B、若为K2SO4、NaNO3、KNO3,无论三种物质以何种比例混合,钾离子和硫酸根离子的个数比都大于1:2,与信息不符,故B错误;
C、若为KNO3、NaNO3、Na2SO4,以1:2:2的比例混合时离子数目比符合题意,故C正确;
D、若为K2SO4、Na2SO4、KNO3,Na+与SO42-的比例为6:3,应恰好消耗没,故不存在K2SO4,故D错误;
故选C.
点评:本题考查物质的量的计算,为高频考点,侧重电荷守恒及离子配比的考查,注意溶质的构成及离子个数的关系即可解答,题目难度中等.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
实验中的下列操作正确的是( )
| A、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中 |
| B、Ba(NO3)2 溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后应冷却至室温再转移到容量瓶中 |
下列实验装置设计正确,且能达到目的是( )
A、 配制稀硫酸溶液 |
B、 合成氨并检验氨的生成 |
C、 碘的CCl4溶液中分离I2并收回CCl4 |
D、 测定乙醇分子结构 |
配制100mL 0.1mol?L-1Na2CO3溶液,下列操作正确的是( )
| A、称取1.06 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 |
| B、称取1.06 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解 |
| C、转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中 |
| D、定容后,塞好瓶塞,反复倒转,摇匀 |
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图象,其中图象和实验结论表达均正确的是( )
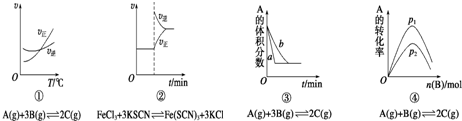

| A、①是其他条件一定时,反应速率随温度变化的图象,正反应△H>0 |
| B、②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象 |
| C、③是在有无催化剂存在下建立的平衡过程图象,b是使用催化剂时的曲线 |
| D、④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2 |
下列说法正确的是( )
| A、滴定管装滴定液时应先用滴定液润洗 |
| B、在50mL量筒中配制0.1000mol?L-1碳酸钠溶液 |
| C、用pH=1的盐酸配制100mLpH=2的盐酸需要100mL容量瓶、烧杯、玻璃棒、胶头滴管 |
| D、欲配制1.00L1.00mol?L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中 |
下列说法正确的是( )
| A、活化分子碰撞即发生化学反应 |
| B、升高温度会加快反应速率,其主要原因是增加了活化分子碰撞的次数 |
| C、有气体参加的化学反应,若增大压强,可增大活化分子百分数,从而使反应速率增大 |
| D、活化分子间的碰撞不一定是有效碰撞 |
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O═O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为( )
| A、188kJ |
| B、436 kJ |
| C、557 kJ |
| D、920 kJ |