题目内容
10.下列饱和溶液中,通入过量二氧化碳气体,肯定没有沉淀产生的是( )①氢氧化钠
②碳酸钠
③硅酸钠
④次氯酸钙
⑤氯化钙.
| A. | ①⑤ | B. | ①② | C. | ④⑤ | D. | ③④ |
分析 向Ca(ClO)2溶液分别通入过量CO2,最终生成Ca(HCO3)2,没有沉淀生成;饱和NaOH、Na2CO3溶液中通入CO2,会析出NaHCO3晶体;饱和Na2SiO3溶液中通入CO2,会析出H2SiO3沉淀;CO2与CaCl2不反应,据此进行判断.
解答 解:①饱和NaOH溶液中分别通入过量CO2,最终会析出NaHCO3晶体,有沉淀生成,故①错误;
②饱和Na2CO3溶液中通入CO2,会析出NaHCO3晶体,故②错误;
③饱和Na2SiO3溶液中通入CO2,会析出H2SiO3沉淀,故③错误;
④Ca(ClO)2溶液分别通入过量CO2,最终生成Ca(HCO3)2,没有沉淀生成,故④正确;
⑤CO2与CaCl2不反应,故⑤正确;
故选C.
点评 本题考查了离子反应发生条件、元素及其化合物的性质等,题目难度不大,注重了基础知识的考查,应该熟练掌握离子反应发生的条件.

 阅读快车系列答案
阅读快车系列答案(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示, K值大小与温度的关系是:温度升高,K值 。(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
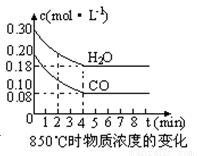
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于 状态;c 1数值 0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 (单选),表中5min~6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
| A. | 增大铁的量可以使反应速率加快 | |
| B. | 将生成的气体在空气中冷却可获得钠 | |
| C. | 每生成1molH2,转移的电子数约为4×6.02×1023 | |
| D. | 该反应条件下铁的金属性比钠强 |
| A. | 过滤时,漏斗的下端管口紧靠烧杯内壁 | |
| B. | 为了加快过滤速度,可用玻璃棒搅动过滤器中的液体 | |
| C. | 实验完毕后,用手直接取走蒸发皿 | |
| D. | 当蒸发皿中的固体完全蒸干后,再停止加热 |
| A. | 纤维素 | B. | 氯乙烯 | C. | 冰醋酸 | D. | 乙酸乙酯 |
| A. | 1mol/L | B. | 2mol/L | C. | 3mol/L | D. | 20mol/L |
 2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为,用O2浓度变化来表示的反应速率为。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 。
2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为,用O2浓度变化来表示的反应速率为。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为 。