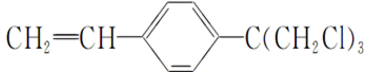
题目内容
17.能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开犮和应用前景.工业上通过媒的气化生成的CO和H2合成甲醇,反应原理为:CO(g)+2H2(g)?CH3OH(g)
(1)在一容积可变的密闭容器中充有10mol CO和20mol H2,在催化剂作用下发生反应生成甲醇.CO的平衡转化率(a)与温度(T)、压强(p)的关系如图1所示.
①合成甲醇的反应为放热(填“放热”或“吸热”)反应.判断理由是温度升高平衡逆向移动,即逆反应方向为吸热,所以正反应方向为放热.平衡常数KA>KC(填“>”、“<”或“=”).
②下列有关该反应的说法正确的是D(填字母序号).
A.当v(CO)生成=2v消耗(H2) 时该反应达到平衡状态
B.其它条件不变,只改变CO和H2的投料量,该反应的焓变发生改变
C.在反应过程中混合气体的密度和相对平均分子质量均不发生变化
D.使用催化剂可以减小反应的活化能
(2)下列措施可以提高甲醇产率的是ACD.
A.压缩容器体积
B.恒容条件下充入He,使体系总压强增大
C.将CH3OH (g)从体系中分离
D.恒压条件下再充入10mol CO和20mol H2
(3)甲醇一一空气燃料电池装置如图2所示.
①该电池甲电极的电极反应式为CH3OH-6e-+H2O=CO2↑+6H+.
②若用此甲醇燃料电池电解200mL-定浓度NaCl与CuSO4的混合溶液(电极为惰性电极,不参与反应),电极产生气体体积(标况下)与电解时间的关系图如图3所示,此溶液中硫酸铜的浓度为0.1mol/L.
分析 (1)①根据温度和CO的转化率确定反应热;温度不变,化学平衡常数不变,温度升高平衡向吸热的方向移动,平衡常数变化;
②A.不同物质的正、逆反应速率之比等于其计量数之比是平衡状态;
B.在一定条件下,焓变是一个定值,与物质投料量无关;
C.相对平均分子质量=$\frac{m}{n}$,这是一个气体体积发生变化的反应,即n变,根据质量守恒定律m不变,故相对平均分子质量变化;
D.使用催化剂可以减小反应的活化能;
(2)根据化学平衡移动原理,增加甲醇产率,即使化学平衡正向移动即可;
(3)①甲醇发生氧化反应,在负极反应,正极是氧气在反应,注意电解质是酸性的,据此书写电极反应式;
②结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,计算时抓住电子守恒.
解答 解:(1)①据图象可知,温度升高平衡逆向移动,即逆反应方向为吸热,所以正反应方向为放热;因B点与A点温度相同,K不变,对于上述反应温度升高平衡向逆反应方向移动,平衡常数减小,所以A、B、C三点的平衡常数KA=KB>KC,
故答案为:放热;温度升高平衡逆向移动,即逆反应方向为吸热,所以正反应方向为放热;>;
②A.不同物质的正、逆反应速率之比等于其计量数之比是平衡状态,故A错误;
B.在一定条件下,焓变是一个定值,与物质投料量无关,故B错误;
C.相对平均分子质量=$\frac{m}{n}$,这是一个气体体积发生变化的反应,即n变,根据质量守恒定律m不变,故相对平均分子质量变化,故C错误;
D.使用催化剂可以减小反应的活化能,故D正确,
故答案为:D;
(2)A、对于反应CO(g)+2H2(g)?CH3OH(g),反应物气体体积大于生成物,压缩容器体积时,压强增大,平衡正向移动,可增加甲醇产率,A正确;
B、充入He,不影响各气体的分压,平衡不移动,不能增加甲醇产率,故B错误;
C、分离出CH3OH,平衡正向移动可提高甲醇产率,故C正确;
D、体积不变,再充入10mol CO和20mol H2反应物气体,平衡正向移动,可增加甲醇产率,故D正确.
故选ACD;
故答案为:ACD;
(3)①氢离子向右移动,说明右面的电极是正极,故甲醇应从b也就是负极通入,即电极甲为负极,负极上甲醇发生失电子的氧化反应,在酸性条件下,电极反应式应为:CH3OH-6e-+H2O=CO2↑+6H+.
故答案为:CH3OH-6e-+H2O=CO2↑+6H+;
②Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系①由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=$\frac{0.224L}{22.4L/mol}$×2=0.02mol,由t2时生成氧气为112mL,n(O2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,
根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=$\frac{0.04mol}{2}$=0.02mol,所以c(CuSO4)=$\frac{0.02mol}{0.2L}$=0.1mol/L,
故答案为:0.1.
点评 本题考查平衡常数影响因素,化学平衡的影响因素,电极方程式的书写,题目难度中等,侧重于考查学生对基础知识的综合应用能力,解题时注意把握化学平衡的影响因素等内容.

| A. | 历史上很多种元素是通过原子光谱发现的 | |
| B. | 鉴别晶体与非晶体,最为科学的方法是X射线衍射法 | |
| C. | 前36号元素中基态电子排布未成对电子数最多的元素,在第四周期第IIIB族 | |
| D. | 金属性越强的金属元素,第一电离能不一定就越小 |
| A. |  | B. |  | C. |  | D. |  |
| A. | SO2在葡萄糖中作抗氧化剂 | B. | Fe3O4常用作红色油漆和涂料 | ||
| C. | SiO2可制成太阳能电池 | D. | 漂粉精可用于游泳池的消毒 |
| A. | c=$\frac{2000ρa}{M}$ | B. | a%=$\frac{c}{2000ρ}$ | C. | M=$\frac{1000ρa%}{c}$ | D. | $S=\frac{100cM}{2000ρ-cM}$ |
| A. | 铁与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 加入反应物,则单位体积内活化分子百分数增大,化学反应速率增大 | |
| C. | 过程的自发性只能用于判断其方向性,不能确定其是否一定会发生和发生的速率 | |
| D. | 中和反应放热说明中和反应前后能量不守恒 |
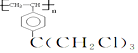 .
.