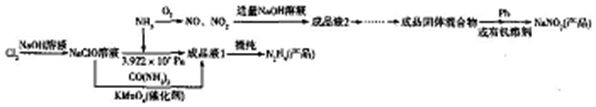
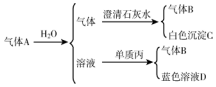
题目内容
11.某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置:倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管的气体的体积为VmL(已折算成标准状况).由上述实验事实可知:
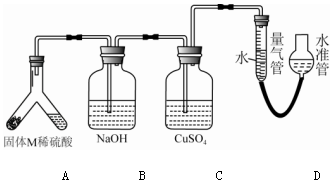
(1)①固体M中一定含有的物质是Fe、FeS(填化学式),理由是装置B增重,说明生成了硫化氢气体,故M中一定含有硫化亚铁,C装置无变化,说明硫化氢已被完全吸收,量气管气体的体积为VmL,说明收集的气体是氢气,说明M中还有铁.
②其中一种物质的质量可以确定为2.5×10-3V(用代数式表示)g.
(2)B装置的名称是洗气瓶;写出B装置中反应的化学方程式:2NaOH+H2S=2H2O+Na2S.
(3)C装置的作用是检验硫化氢气体是否完全被B装置吸收,如果实验中没有B装置,则C装置中产生的现象是硫酸铜溶液中出现黑色沉淀.
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是硫,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是漏斗、玻璃棒.
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是bc.
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥.
分析 (1)铁和硫在隔绝空气的情况下反应生成硫化亚铁,故M可能为FeS、S、Fe,使硫酸和固体M充分反应,装置B增重,说明生成了硫化氢气体,故M中一定含有硫化亚铁,C装置无变化,说明硫化氢已被完全吸收,量气管气体的体积为VmL,说明收集的气体是氢气,说明M中还有铁,根据氢气的体积可计算出铁的质量;
(2)根据B装置的作用分析;氢氧化钠和硫化氢反应生成硫化钠和水;
(3)C装置作用为检验硫化氢是否完全吸收,若有硫化氢会和硫酸铜反应生成黑色的硫化铜沉淀;
(4)根据硫的物理性质及过滤操作所需仪器解答;
(5)测定气体体积时水准管的水面高于量气管的水面,则测得气体体积小于实际体积,造成据此计算出固体M中铁的质量比实际偏小.
解答 解:(1)①铁和硫在隔绝空气的情况下反应生成硫化亚铁,故M可能为FeS、S、Fe,使硫酸和固体M充分反应,装置B增重,说明生成了硫化氢气体,故M中一定含有硫化亚铁,C装置无变化,说明硫化氢已被完全吸收,量气管气体的体积为VmL,说明收集的气体是氢气,说明M中还有铁,通过以上分析知,固体中含有Fe、FeS,
故答案为:Fe、FeS;装置B增重,说明生成了硫化氢气体,故M中一定含有硫化亚铁,C装置无变化,说明硫化氢已被完全吸收,量气管气体的体积为VmL,说明收集的气体是氢气,说明M中还有铁;
②其中一种物质的质量可以确定为铁,铁和硫酸反应的离子方程式为:
Fe+2H+=Fe2++H2↑
56g 22.4L
m V×10-3L
m=$\frac{56g×V×1{0}^{-3}L}{22.4L}$=2.5×10-3Vg;
其中一种物质的质量可以确定为2.5×10-3Vg,
故答案为:2.5×10-3V;
(2)B装置能吸收气体,为洗气瓶,硫化氢和氢氧化钠反应生成硫化钠和水,反应的化学方程式为:2NaOH+H2S=2H2O+Na2S,
故答案为:洗气瓶;2NaOH+H2S=2H2O+Na2S;
(3)C装置作用为检验硫化氢是否完全吸收,若有硫化氢会和硫酸铜反应生成黑色的硫化铜沉淀;
故答案为:检验硫化氢气体是否完全被B装置吸收;硫酸铜溶液中出现黑色沉淀;
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是硫,硫不溶于水,故可采取过滤方法分离,过滤所需仪器为烧杯、漏斗、玻璃棒;
故答案为:硫;漏斗;玻璃棒;
(5)测定气体体积时水准管的水面高于量气管的水面,则测得气体体积小于实际体积,造成据此计算出固体M中铁的质量比实际偏小,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,M中有未反应的铁和硫;因测量气体的体积是通过排出水的体积来测量的,只要生成气体,由于压强增大,气体就膨胀,排出水,增加的气体可排出水的体积相同,故A中留有反应生成的气体,气体进入D装置前未用浓硫酸干燥都不影响气体的体积,
故答案为:bc.
点评 本题考查了探究物质组成的测定,明确物质的性质是解本题关键,再结合物质之间的反应来分析解答,知道每个装置中发生的反应,题目难度中等.

| A. | 碳酸钙溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 铜溶于硫酸酸化的H2O2溶液:Cu+2H++H2O2═Cu2++2H2O | |
| C. | 少量SO2通入氨水中:SO2+NH3•H2O═NH4++HSO3- | |
| D. | 向A12(SO4)3溶液中加少量Ba(OH)2溶液:Al3++SO42-+Ba2++3OH-═BaSO4↓+Al(OH)3↓ |
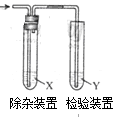 用图所示装置检验乙烯时不需要除杂的是( )
用图所示装置检验乙烯时不需要除杂的是( )| 乙烯 的制备 | 试剂X | 剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | CH3CH2OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | CH3CH2OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
| 古文记载 | 对应的化学知识 | |
| A | 谚语:“雷雨发庄稼” | 放电条件下,氮气茎干一系列变化可以转化为氮肥 |
| B | 《望庐山瀑布》:“日照香炉生紫烟” | 碘的升华 |
| C | 《石灰吟》:“粉身碎骨浑不怕,要留清白在人间” | 碳酸钙高温下分解 |
| D | 《梦溪笔谈》中对宝剑的记载:“以剂钢为刃,柔铁为茎干,不尔则多断折” | 剂钢指的是铁的合金,其硬度比纯铁大 |
| A. | A | B. | B | C. | C | D. | D |