题目内容
1.将红热的黑色固体单质甲放入乙的浓溶液中剧烈反应产生混合气体A,A在常温下不与空气作用,有如图变化关系: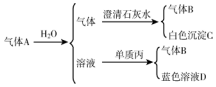
(1)推导出各物质的化学式:BNODCu(NO3)2;
(2)写出化学反应方程式:
①甲与乙的反应:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
②气体与澄清石灰水反应:CO2+Ca(OH)2=CaCO3↓+H2O,3NO2+H2O=2HNO3+NO,2HNO3+Ca(OH)2=CaCl2+2H2O.
分析 单质丙和溶液反应生成蓝色溶液,则该蓝色溶液中含有铜离子,该溶液为气体A和水反应生成的,则该溶液应该是酸,则丙是Cu,铜和稀硝酸在常温下反应,则该溶液为HNO3,气体B是NO,根据元素守恒知,A中含有NO2,通入水后的A中气体能和澄清石灰水反应生成白色沉淀,且还剩余NO,根据元素守恒及物质颜色知,甲是C,乙是浓硝酸,则A中含有CO2、NO2,结合对应物质的性质以及题目要求解答该题.
解答 解:(1)单质丙和A与水反应后的溶液发生反应生成蓝色溶液,则该蓝色溶液中含有铜离子,气体A和水反应生成的溶液应该是酸,则丙是Cu,铜和稀硝酸在常温下反应,则A与水反应后的溶液中含有HNO3,气体B是NO,根据元素守恒知,A中含有NO2,通入水后的A中气体能和澄清石灰水反应生成白色沉淀,且还剩余NO,根据元素守恒及物质颜色知,甲是C,乙是浓硝酸,则A中含有CO2、NO2,
根据以上分析知,甲、乙、丙分别是:C、HNO3(浓)、Cu,A为CO2、NO2,B为NO,C为CaCO3,D为Cu(NO3)2,
故答案为:NO;Cu(NO3)2;
(2)①甲与乙反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
②气体与澄清石灰水反应为:CO2+Ca(OH)2=CaCO3↓+H2O,3NO2+H2O=2HNO3+NO,2HNO3+Ca(OH)2=CaCl2+2H2O,
故答案为:CO2+Ca(OH)2=CaCO3↓+H2O,3NO2+H2O=2HNO3+NO,2HNO3+Ca(OH)2=CaCl2+2H2O.
点评 本题考查无机物的推断,涉及碳、氮元素单质及化合物的性质,E溶液为蓝色是推断的突破口,据此可以推断丙,再结合转化关系确定乙为硝酸,熟练掌握元素化合物的性质是关键,题目难度中等.

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | Na2S | B. | BaCl2 | C. | Ba(NO3)2 | D. | Ca(OH)2 |
| 实验事实 | 结论 | |
| A | 常温下白磷可自燃,而氮气要在放电条件下才与氧气反应 | 氮气的化学性质比磷稳定 |
| B | CO2的水溶液可导电 | CO2是电解质 |
| C | SO2通入到氯化钡溶液中出现白色沉淀 | 沉淀为亚硫酸钡 |
| D | 向某无色溶液中滴入少量NaOH溶液,用湿润的红色石蕊试纸放在试管口检验,试纸不变蓝色 | 无色溶液中不含NH4+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氯气=氨水 | B. | 氯水>氨水 | C. | 氯水<氨水 | D. | 无法判断 |
| A. | CuO | B. | FeO | C. | C | D. | CaCO3 |
| A. | 用湿润的蓝色石蕊试纸 | B. | 用湿润的有色布条 | ||
| C. | 将气体通入AgNO3溶液 | D. | 用湿润的淀粉碘化钾试纸 |
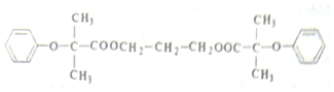
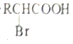 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$
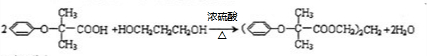 .
.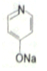 (
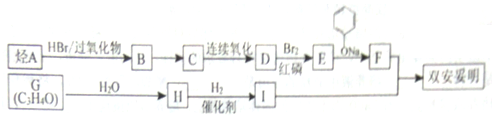
( 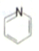 与苯环性质相似)与
与苯环性质相似)与  合成
合成 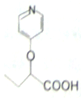 的路线:
的路线: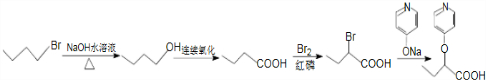 .
. 氧化锌、硫化锌都是重要的基础化工原料.
氧化锌、硫化锌都是重要的基础化工原料.