题目内容
1.下列排列顺序不正确的是( )| A. | 原子半径:Na>Si>O | B. | 热稳定性:HF>H2O>NH3 | ||
| C. | 碱性:CsOH>KOH>NaOH | D. | 失电子能力:Al>Mg>Na |
分析 A.电子层越多,原子半径越大,同周期中原子序数大的原子半径小;
B.非金属性越强,对应氢化物越稳定;
C.金属性越强,对应碱的碱性越强;
D.金属性越强,失去电子的能力越强.
解答 解:A.电子层越多,原子半径越大,同周期中原子序数大的原子半径小,则原子半径为Na>Si>O,故A正确;
B.非金属性F>O>N,则热稳定性:HF>H2O>NH3,故B正确;
C.金属性Cs>K>Na,碱性:CsOH>KOH>NaOH,故C正确;
D.金属性Na>Mg>Al,则失去电子的能力为Na>Mg>Al,故D错误;
故选D.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.现将等物质的量的CuSO4、FeCl3、Zn放入盛有水的烧杯中充分反应,所得溶液中除SO42-、Cl-外,还含有的金属阳离子是( )
| A. | Zn2+、Cu2+、Fe3+ | B. | Zn2+、Cu2+、Fe2+ | ||
| C. | Zn2+、Fe2+、Cu2+、Fe3+ | D. | Zn2+、Fe3+ |
9.有下列八种物质:①氯化钙、②金刚石、③硫、④氢氧化钠、⑤二氧化硅、⑥干冰,回答有关这八种物质的问题.(用编号回答)
(1)将这八种物质按不同晶体类型分成四组,并填写下表:
(2)属于共价化合物的是⑤⑥;含有共价键的离子化合物是④;
(3)其中硬度最大的物质是②;熔点最低的物质是⑥.
(1)将这八种物质按不同晶体类型分成四组,并填写下表:
| 晶体类型 | 离子晶体 | 原子晶体 | 分子晶体 |
| 各组中物质的编号 | ①④ | ②⑤ | ③⑥ |
(3)其中硬度最大的物质是②;熔点最低的物质是⑥.
11.N5是破坏力极强的炸药之一,18O2是比黄金还贵重的物质.下列说法正确的是( )
| A. | 2N5 →5N2是化学变化 | B. | N5和N2互为同位素 | ||
| C. | 原子半径:r(N)<r(O) | D. | 18O2中含18个中子 |
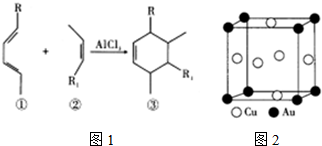
 ;④CH4与C3H8;⑤CH3CH2CH2CH3与
;④CH4与C3H8;⑤CH3CH2CH2CH3与 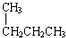 .请回答下列问题:
.请回答下列问题: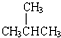 的名称是2-甲基丙烷.
的名称是2-甲基丙烷.

 .
. .
. 与过量的
与过量的 也可以发生Reformatsky反应,试写出该生成物的结构简式
也可以发生Reformatsky反应,试写出该生成物的结构简式 .
.