题目内容
下列叙述不正确的是( )
| A、等温等压下,3mol C2H2(g) 和1molC6H6(g)的密度相等 |
| B、同质量、不同密度的N2和CO气体所含原子数一定相等 |
| C、温度和密度都相同,Ne、H2、O2三种气体的压强大小:p(H2)>p(Ne)>p(O2) |
| D、任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等 |
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、等温等压下,气体摩尔体积相同,ρ=
=
=
分析判断.
B、同质量的氮气和一氧化碳的物质的量相同,结合一个分子中含有的原子数判断含有的总原子数.
C、根据PV=nRT得,P=
,由此得出气体压强的相对大小.
D、根据N=nNA判断分子数的相对大小.
| m |
| V |
| nM |
| nVm |
| M |
| Vm |
B、同质量的氮气和一氧化碳的物质的量相同,结合一个分子中含有的原子数判断含有的总原子数.
C、根据PV=nRT得,P=
| ρRT |
| M |
D、根据N=nNA判断分子数的相对大小.
解答:
解:A、等温等压下,气体摩尔体积相同,根据ρ=
=
=
知,两种气体的摩尔质量不等导致其密度不等,故A错误.
B、同质量的氮气和一氧化碳的物质的量相同,一个氮气分子和一个一氧化碳分子中含有的原子数相同,结合N=nNA知,同质量、不同密度的N2和CO气体所含原子数一定相等,故B正确.
C、根据PV=nRT得,P=
,气体的温度和密度相同,由此知,气体的摩尔质量越大压强越小,所以Ne、H2、O2三种气体的压强大小:p(H2)>p(Ne)>p(O2),故C正确.
D、根据N=nNA知,气体的分子数与物质的量成正比,与其它条件无关,所以等物质的量的乙烯和一氧化碳所含的分子数必相等,故D正确.
故选A.
| m |
| V |
| nM |
| nVm |
| M |
| Vm |
B、同质量的氮气和一氧化碳的物质的量相同,一个氮气分子和一个一氧化碳分子中含有的原子数相同,结合N=nNA知,同质量、不同密度的N2和CO气体所含原子数一定相等,故B正确.
C、根据PV=nRT得,P=
| ρRT |
| M |
D、根据N=nNA知,气体的分子数与物质的量成正比,与其它条件无关,所以等物质的量的乙烯和一氧化碳所含的分子数必相等,故D正确.
故选A.
点评:本题考查了阿伏伽德罗定律及推论,难点是C,要根据克拉伯龙方程分析解答,克拉伯龙方程在中学阶段已经不涉及,难度较大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
古诗词是古人为我们留下的宝贵精神财富.下列诗句中只涉及物理变化的是( )
| A、野火烧不尽,春风吹又生 |
| B、春蚕到死丝方尽,蜡炬成灰泪始干 |
| C、只要功夫深,铁杵磨成针 |
| D、爆竹一声除旧岁,春风送暖入屠苏 |
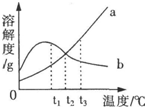 有关a、b两种物质的溶解度曲线如图所示,下列叙述不正确的是( )
有关a、b两种物质的溶解度曲线如图所示,下列叙述不正确的是( )| A、a物质的溶解度随着温度的升高而增大 |
| B、在t2℃时,a、b两种物质的溶液中溶质的质量分数一定相等 |
| C、t3℃时,a物质的溶解度大于b物质的溶解度 |
| D、将a、b两种物质的饱和溶液从t3℃降温至t1℃,a有晶体析出,b无晶体析出 |





 取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,通过计算回答:
取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,通过计算回答: