题目内容
写出下列反应的化学方程式,是离子反应的只写离子方程式.
(1)澄清石灰水与少量碳酸氢钠溶液反应:
(2)氯气通入氢氧化钠溶液中:
(3)实验室制氨气:
(4)铜和浓硝酸反应:
(5)铝和氢氧化钠溶液反应: .
(1)澄清石灰水与少量碳酸氢钠溶液反应:
(2)氯气通入氢氧化钠溶液中:
(3)实验室制氨气:
(4)铜和浓硝酸反应:
(5)铝和氢氧化钠溶液反应:
考点:离子方程式的书写,化学方程式的书写
专题:离子反应专题
分析:(1)碳酸氢钠完全反应,生成碳酸钙、NaOH、水;
(2)反应生成氯化钠、次氯酸钠、水;
(3)实验室利用氯化铵与碱石灰共热来制取氨气,不属于离子反应;
(4)反应生成硝酸铜、二氧化氮和水;
(5)反应生成偏铝酸钠和氢气.
(2)反应生成氯化钠、次氯酸钠、水;
(3)实验室利用氯化铵与碱石灰共热来制取氨气,不属于离子反应;
(4)反应生成硝酸铜、二氧化氮和水;
(5)反应生成偏铝酸钠和氢气.
解答:
解:(1)碳酸氢钠完全反应,生成碳酸钙、NaOH、水,离子反应为Ca2++OH-+HCO3-
CaCO3↓+H2O,
故答案为:Ca2++OH-+HCO3-
CaCO3↓+H2O;
(2)反应生成氯化钠、次氯酸钠、水,离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)实验室利用氯化铵与碱石灰共热来制取氨气,不属于离子反应,该化学反应为2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+H2O,故答案为:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+H2O;
(4)反应生成硝酸铜、二氧化氮和水,离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(5)反应生成偏铝酸钠和氢气,该反应的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
| ||
故答案为:Ca2++OH-+HCO3-
| ||
(2)反应生成氯化钠、次氯酸钠、水,离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)实验室利用氯化铵与碱石灰共热来制取氨气,不属于离子反应,该化学反应为2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+H2O,故答案为:2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+H2O;
(4)反应生成硝酸铜、二氧化氮和水,离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(5)反应生成偏铝酸钠和氢气,该反应的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意(5)中水参加反应为易错点,熟悉离子反应方程式书写的注意事项和方法即可解答,题目难度不大.

练习册系列答案
相关题目
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A、106 g Na2CO3晶体中的离子总数大于3NA |
| B、在铜与硫的反应中,1 mol铜失去的电子数为2NA |
| C、在25℃时,压强为1.01×105帕时,11.2L氧气所含的原子数为NA |
| D、0.5mol铝与足量烧碱溶液反应,转移的电子数为1.5NA |
下列物质中S的化合价为+4的是( )
| A、S |
| B、SO2 |
| C、BaSO4 |
| D、H2SO4 |
下列各项都是物质的性质,其中属于物理性质的是( )
①挥发性 ②密度 ③溶解性 ④导电导热性 ⑤不稳定性 ⑥可燃性 ⑦金属的延展性 ⑧助燃性 ⑨熔点 ⑩色、味、态.
①挥发性 ②密度 ③溶解性 ④导电导热性 ⑤不稳定性 ⑥可燃性 ⑦金属的延展性 ⑧助燃性 ⑨熔点 ⑩色、味、态.
| A、①②③⑤ | B、④⑤⑥⑦ |
| C、②③⑧⑨ | D、①②③④⑦⑨⑩ |
下列实验操作会引起测定结果偏低的是( )
| A、用量筒量取8.2mL某溶液时俯视读数 |
| B、中和滴定用的锥形瓶加人待测液后,再加少量蒸馏水稀释 |
| C、测定一包白色粉末的质量.将药品放在右盘,砝码放在左盘,并移动游码使之平衡 |
| D、配制0.1 mol/L的NaOH溶液100mL,未经冷却即注入容量瓶定容 |
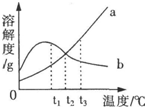 有关a、b两种物质的溶解度曲线如图所示,下列叙述不正确的是( )
有关a、b两种物质的溶解度曲线如图所示,下列叙述不正确的是( )| A、a物质的溶解度随着温度的升高而增大 |
| B、在t2℃时,a、b两种物质的溶液中溶质的质量分数一定相等 |
| C、t3℃时,a物质的溶解度大于b物质的溶解度 |
| D、将a、b两种物质的饱和溶液从t3℃降温至t1℃,a有晶体析出,b无晶体析出 |