题目内容
9.绿矾(FeSO4•7H2O)在工业上有重要的用途.图是FeSO4•7H2O实验室制备流程图.根据题意完成下列填空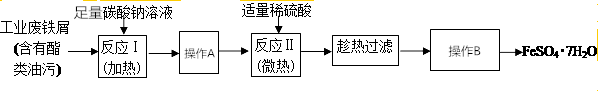
(1)碳酸钠溶液能除去脂类油污,是因为CO32-水解:CO32-+H2O
 HCO3-+OH-,溶液呈碱性,酯在碱性条件下完全水解(结合离子方程式解释),反应Ⅰ需要加热,其原因是升高温度,促进水解,溶液碱性增强,使反应充分进行.
HCO3-+OH-,溶液呈碱性,酯在碱性条件下完全水解(结合离子方程式解释),反应Ⅰ需要加热,其原因是升高温度,促进水解,溶液碱性增强,使反应充分进行.(2)反应Ⅱ需要100mL1.5mol•L-1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1.84g•cm-3的浓H2SO4配置,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及100mL容量瓶
(3)废铁屑中含氧化铁,无需在制备前除去,理由是(用离子方程式回答)Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+.
(4)判断反应Ⅱ完成的现象是铁粉不再溶解,铁粉表面不再有气泡产生.
(5)操作A是过滤,操作B是洗涤、干燥.
分析 用饱和的碳酸钠溶液洗去铁屑表面的油污,过滤分离得到Fe,Fe与硫酸反应得到硫酸亚铁,过滤分离得到硫酸亚铁溶液,再经过蒸发浓缩、冷却结晶、过滤等操作可得到FeSO4•7H2O.
(1)碳酸钠溶液呈碱性,使油脂在碱性条件下发生水解;盐的水解为吸热反应,升温促进水解,溶液碱性增强;
(2)配制100mL1.5mol•L-1的稀H2SO4溶解洁净的铁屑,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及100mL容量瓶;
(3)氧化铁与硫酸反应生成硫酸铁,Fe与硫酸铁反应生成硫酸亚铁;
(4)硫酸反应完毕时,不再有氢气生成、Fe粉不再溶解;
(5)操作A是分离互不相溶的固体与液体,操作B是对过滤后的晶体进行洗涤、干燥.
解答 解:用饱和的碳酸钠溶液洗去铁屑表面的油污,过滤分离得到Fe,Fe与硫酸反应得到硫酸亚铁,过滤分离得到硫酸亚铁溶液,再经过蒸发浓缩、冷却结晶、过滤等操作可得到FeSO4•7H2O.
(1)CO32-水解:CO32-+H2O
故答案为:CO32-水解:CO32-+H2O
(2)用量筒量取浓硫酸体积,再烧杯中稀释,并用玻璃棒搅拌,冷却后移入1mol容量瓶中,加水中刻度线1-2cm处改用胶头滴管定容,
故答案为:100mL容量瓶;
(3)废铁中含氧化铁,无需制备前除去,因最终溶液是FeSO4溶液,氧化铁和硫酸生成硫酸铁、铁和硫酸铁生成硫酸亚铁,离子方程式为:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,
故答案为:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+;
(4)铁与硫酸反应基本完成的现象是:溶液中不再有气泡产生、铁粉不再溶解,
故答案为:铁粉不再溶解,铁粉表面不再有气泡产生;
(5)操作A是分离互不相溶的固体与液体,采取过滤操作,操作B是对过滤后得到的硫酸亚铁晶体进行洗涤、干燥,
故答案为:过滤;洗涤、干燥.
点评 本题考查物质制备工艺流程,涉及物质的分离提纯、对原理的分析评价、溶液配制等,熟练掌握元素化合物知识,有利于培养学生分析能力、实验能力,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | c(Cl-)=c(NH3•H2O)+c(NH4+) | |
| B. | c(Cl-)>c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | c(Cl-)+c(OH-)=c(Na+)+c(NH4+)+c(H+) | |
| D. | c(NH3•H2O)+c(OH-)=c(Na+)+c(NH4+)+c(H+) |
(1)基态P原子中,电子占据的最高能级符号为3p,基态N原子核外有7种运动状态不同的电子,基态Br原子的价电子排布式为4S24P5.
(2)HCN的结构式为H-C≡N;其中心C原子的杂化类型为sp杂化.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).
(3)已知PCl3是不稳定的无色液体,遇水反应可生成两种酸,该反应的化学方程式 为PCl3+3 H2O=H3PO3+3HCl,所得含氧酸(已知该含氧酸的各步电离平衡常数分别为Ka1=1.6×10-2和Ka2=7×10-7)和足量的NaOH溶液反应生成盐的化学式为Na2HPO3.
(4)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是碘(填元素名称)
| F | Cl | Br | I | |
| 第一电离能((kJ•mol-1)) | 1681 | 1251 | 1140 | 1008 |
| A. | CH3CH2OH+CH3COOH $→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| B. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | |
| C. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| D. |  |
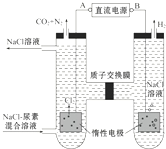
| A. | B为电源的正极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将升高 | |
| C. | 电子移动的方向是B→右侧惰性电极→质子交换膜→左侧惰性电极→A | |
| D. | 阳极室中发生的反应依次为2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl |
| A. | 质子数为222 | |
| B. | 中子数为86 | |
| C. | 质量数为308 | |
| D. | 与${\;}_{86}^{219}$Rn、${\;}_{86}^{220}$Rn互为同位素 |
 是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称醛基、羟基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.
是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称醛基、羟基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.
 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
. )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛( )合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).

 .
. 天津“8•12”爆炸事故发生后,核心区出现了一个深达六七米已被氰化物等污染的巨大水坑.专业人员将污水抽出后,用专用槽车拉到“破氰装置”里进行处理.“破氰装置”里盛有的化学试剂主要是( )
天津“8•12”爆炸事故发生后,核心区出现了一个深达六七米已被氰化物等污染的巨大水坑.专业人员将污水抽出后,用专用槽车拉到“破氰装置”里进行处理.“破氰装置”里盛有的化学试剂主要是( )