题目内容
1.医疗上用放射性元素氡(${\;}_{86}^{222}$Rn)治疗癌症.下列有关${\;}_{86}^{222}$Rn的说法正确的是( )| A. | 质子数为222 | |
| B. | 中子数为86 | |
| C. | 质量数为308 | |
| D. | 与${\;}_{86}^{219}$Rn、${\;}_{86}^{220}$Rn互为同位素 |
分析 A.${\;}_{86}^{222}$Rn的质子数为86;
B.根据N=A-Z计算;
C.${\;}_{86}^{222}$Rn的质量数为222;
D.同一种元素的不同核素互为同位素.
解答 解:A.${\;}_{86}^{222}$Rn的质子数为86,故A错误;
B.${\;}_{86}^{222}$Rn的质子数为86,质量数为222,中子数为222-86=136,故B错误;
C.${\;}_{86}^{222}$Rn的质量数为222,故C错误;
D.${\;}_{86}^{222}$Rn和${\;}_{86}^{219}$Rn、${\;}_{86}^{220}$Rn都是同一种元素的不同核素,互为同位素,故D正确;
故选D.
点评 本题考查原子的表示方法和同位素的概念,难度不大,明确原子的表示方法和A=Z+N是解题的关键.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 |
6.某澄清溶液中存在大量的Ba2+、NH4+、Cl-,该溶液中还可能大量存在的离子是( )
| A. | Fe3+ | B. | CO32- | C. | Ag+ | D. | OH- |
13.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液与过量的氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 钠和硫酸铜溶液的反应:2Na+Cu2+═2Na++Cu | |
| C. | 铜与浓硝酸反应:Cu+NO3-+4H+═Cu2++NO2↑+2H2O | |
| D. | 氯气与水反应:Cl2+H2O?H++Cl-+HClO |
10.学习化学反应速率时,我们可以用物理上的速率知识来大胆类推学习,二者在许多方面都是极其相似的.下列关于化学反应速率的说法中,不正确的是( )
| A. | 化学反应速率是衡量化学反应进行快慢程度的物理量 | |
| B. | 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 | |
| C. | 在同一个反应中,用各物质表示的反应速率之比等于其化学方程式中的化学计量数之比 | |
| D. | 化学反应速率的常用单位有mol•L-1•s-1和mol/(L•min) |
11.铁及碳的化合物在社会生产、生活中有着广泛的应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一.
已知:①Fe3O4(s)+4C(s)?3Fe(s)+4CO(g)△H=+646.0kJ•mol-1
②C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)△H=-44.0kJ/mol.
(2)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
①从表中数据可推断,该反应是吸热(填“放热”或“吸热”)反应.
②温度为973K时,在某恒容密闭容器中发生上述反应.下列有关说法能说明该反应已达到平衡状态的是BD(填字母).
A.c(CO2)=c(CO) B.v正(CO2)=v逆(CO)
C.体系压强不变 D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+CO2(g)?CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:

①图2中若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=0.006mol•L-1•s-1.
②图1中t2时刻改变的条件是加入催化剂或增大压强(任写两种,下同);图2中t2时刻改变的条件是降低温度或增大水蒸气浓度或减小氢气浓度.
(4)水煤气中的CO和H2均可作为燃料电池的燃料.若在某燃料电池一极通入CO,另一极通入O2和CO2,熔融碳酸钠作为电解质,工作时负极反应式为CO+CO32--2e-=2CO2;若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为6.72L
(标准状况下).
(1)磁铁矿是工业上冶炼铁的原料之一.
已知:①Fe3O4(s)+4C(s)?3Fe(s)+4CO(g)△H=+646.0kJ•mol-1
②C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则Fe3O4(s)+4CO(g)?3Fe(s)+4CO2(g)△H=-44.0kJ/mol.
(2)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H的平衡常数为K,在不同温度下,K值如下:
| 温度/K | 973 | 1173 | 1373 | 1573 |
| K | 1.47 | 2.15 | 3.36 | 8.92 |
②温度为973K时,在某恒容密闭容器中发生上述反应.下列有关说法能说明该反应已达到平衡状态的是BD(填字母).
A.c(CO2)=c(CO) B.v正(CO2)=v逆(CO)
C.体系压强不变 D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+CO2(g)?CO(g)+H2O(g)△H>0有关量与反应时间之间的关系:

①图2中若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=0.006mol•L-1•s-1.
②图1中t2时刻改变的条件是加入催化剂或增大压强(任写两种,下同);图2中t2时刻改变的条件是降低温度或增大水蒸气浓度或减小氢气浓度.
(4)水煤气中的CO和H2均可作为燃料电池的燃料.若在某燃料电池一极通入CO,另一极通入O2和CO2,熔融碳酸钠作为电解质,工作时负极反应式为CO+CO32--2e-=2CO2;若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为6.72L
(标准状况下).
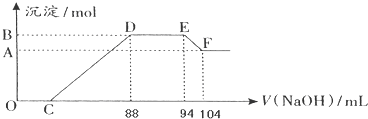
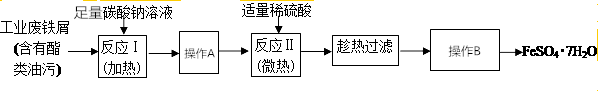
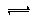 HCO3-+OH-,溶液呈碱性,酯在碱性条件下完全水解(结合离子方程式解释),反应Ⅰ需要加热,其原因是升高温度,促进水解,溶液碱性增强,使反应充分进行.
HCO3-+OH-,溶液呈碱性,酯在碱性条件下完全水解(结合离子方程式解释),反应Ⅰ需要加热,其原因是升高温度,促进水解,溶液碱性增强,使反应充分进行.
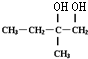 +O2 $→_{△}^{催化剂}$
+O2 $→_{△}^{催化剂}$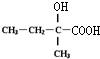 +H2O⑥
+H2O⑥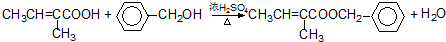
 .
.