题目内容
7.Cl2是纺织工业中常用的漂白剂,Na2S2O3可作漂白布匹后的“脱氯剂”.S2O32-和Cl2反应的产物之一为SO42-.下列说法中不正确的是( )| A. | 该反应中Cl2发生还原反应 | |
| B. | 该反应中S2O32-为还原剂,Cl-为还原产物 | |
| C. | 脱氯反应后,溶液的酸性增强 | |
| D. | SO2与氯气的漂白原理相同,所以也可以用SO2作纺织工业的漂白剂 |
分析 2O32-和Cl2反应的产物之一为SO42-,S硫元素平均化合价由+2价升高为+6价,Na2S2O3是还原剂,Cl2→NaCl、HCl,Cl元素化合价由0价降低为-1价,Cl2是氧化剂,根据电子转移相等,所以n(Na2S2O3)×2×(6-2)=n(Cl2)×2,故n(Na2S2O3):n(Cl2)=1:4,结合质量守恒定律配平反应的方程式为:5H2O+S2O32-+4Cl2=2SO42-+8Cl-+10H+,结合氧化还原反应中的概念及规律来解答.
解答 解:S2O32-和Cl2反应的产物之一为SO42-,S元素的化合价升高,则Cl元素的化合价降低,配平后的反应为:5H2O+S2O32-+4Cl2=2SO42-+8Cl-+10H+,
A.因Cl元素的化合价降低,所以氧化剂是Cl2,反应中被还原,故A正确;
B.S元素的化合价升高,则Cl元素的化合价降低,则该反应中S2O32-为还原剂,Cl-为还原产物,故B正确;
C.由反应可知生成氢离子,酸性增强,故C正确;
D.SO2与氯气的漂白原理不相同,氯气是利用其氧化性,而二氧化硫是利用化合反应,故D错误;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列有关物质制备及应用的说法不正确的是( )
| A. | 很早以前人们用加热胆矾或绿矾的方法制取硫酸 | |
| B. | 将氢气在氯气中燃烧生成氯化氢,然后溶于水得到盐酸,工业上常用此法制取盐酸 | |
| C. | 苏打是焙制糕点所用的发酵粉的主要成分之一,还可以用来治疗胃酸过多的一种药剂 | |
| D. | “水玻璃”是建筑行业中经常使用的一种黏合剂,同时也可用作防腐剂和防火剂 |
12.下列关于物质或离子检验的叙述正确的是( )
| A. | 在溶液中加硫酸钠溶液,有白色沉淀生成,则证明原溶液中一定有Ba2+ | |
| B. | 气体通过CuSO4粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 某溶液中加入稀硫酸,放出无色无味气体,将该气体通入澄清石灰水,溶液变浑浊,证明原溶液中一定含有CO32- |
19.在FeBr2和FeI2混合溶液中逐渐通氯气,不可能发生的反应离子方程式是( )
| A. | 2I-+Cl2═I2+2Cl- | |
| B. | 2Fe2++2Br-+2I-+3Cl2═2Fe3++I2+Br2+6Cl- | |
| C. | 2Fe2++4Br-+2I-+4Cl2═2Fe3++I2+2Br2+8Cl- | |
| D. | 4Fe2++2Br-+2I-+4Cl2═4Fe3++I2+Br2+8Cl- |
5.某有机物结构简式如图所示,下列有关该有机物叙述正确的是( )


| A. | 该有机物分子式为C 9H 8O 3 | |
| B. | 该有机物可以和氯化铁溶液发生显色反应 | |
| C. | 1 mo1该有机物与溴水反应,最多消耗2 mol Br 2 | |
| D. | 1 mol该有机物最多与2 mol NaOH反应 |

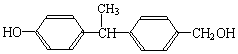 b.
b.
 d.
d.
 结构相似的醇不能被氧化为醛或酸.
结构相似的醇不能被氧化为醛或酸.
 .
.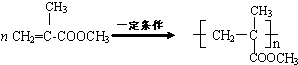 .
.