题目内容
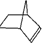
如图所示,将锌片和铜片通过导线相连,置于稀硫酸中.下列说法正确的是( )


| A、铜片上有气泡逸出 |
| B、溶液的SO42-浓度逐渐减小 |
| C、电子由铜片经导线流向锌片 |
| D、该装置能将电能转化为化学能 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:锌比铜活泼,形成原电池反应时,锌为负极,被氧化,铜为正极,正极发生还原反应生成氢气,电子由负极经导线流向正极,以此解答该题.
解答:
解:A.铜为正极,正极发生还原反应,氢离子得电子生成氢气,故A正确;
B.SO42-不参加电极反应,浓度不变,故B错误;
C.电子从负极沿导线流向正极,即电子从Zn沿导线流向Cu,故C错误;
D.该装置是原电池,原电池是把化学能转变为电能的装置,故D错误.
故选A.
B.SO42-不参加电极反应,浓度不变,故B错误;
C.电子从负极沿导线流向正极,即电子从Zn沿导线流向Cu,故C错误;
D.该装置是原电池,原电池是把化学能转变为电能的装置,故D错误.
故选A.
点评:本题考查了原电池原理,为高考高频考点,侧重于学生的分析能力的考查,注意把握原电池的电极判断以及电解方程式的书写,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、1.0 mo1?L-1的Na2CO3溶液中:c(OH-)═c(HCO3-)+c(H+)+c(H2CO3) |
| B、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、0.1 mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3->c(CO32-)>c(H2CO3) |
| D、一定量(NH4)2SO4与NH3?H2O混合所得的酸性溶液中:c(NH4+)<2c(SO42-) |
10mL 1mol?L-1盐酸与一小块大理石的化学反应:CaCO3+2HCl═CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )
| A、加入一定量的CaCl2 |
| B、加入5 mL 1.5 mol?L-1盐酸 |
| C、加入15 mL 0.5 mol?L-1盐酸 |
| D、加入5 mL H2O |
高铁电池是一种新型可充电电池,电解质溶液为KOH,放电时的总反应式为3Zn+2K2FeO4+8H2O?3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A、放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 |
| B、放电时OH-向正极移动 |
| C、充电时每转移3mol电子,阳极有1molFe(OH)3被还原 |
| D、充电时阳极反应式为:3Zn(OH)2+6e-═3Zn+6OH- |
根据右面的能量变化示意图,确定下列选项中正确的是( )


| A、2 A(g)+B(g)═2 C(g)△H<0 |
| B、2 A(g)+B(g)═2 C(g)△H>0 |
| C、2 C(g)═2A(g)+B(g) H>0 |
| D、2C(g)═2 A(g)+B(g) H<0 |
 已知:①反应2C+O2=2CO 的能量变化如图所示.②含5.6g KOH的稀溶液与0.5L 0.1mol/L的H2SO4溶液反应放出5.73kJ的热量.下列说法正确的是( )
已知:①反应2C+O2=2CO 的能量变化如图所示.②含5.6g KOH的稀溶液与0.5L 0.1mol/L的H2SO4溶液反应放出5.73kJ的热量.下列说法正确的是( )| A、2mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ |
| B、12g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ |
| C、该反应的热化学方程式是:2C(s)+O2(g)=2CO(g)△H=-110.5 kJ/mol |
| D、表示中和热的热化学方程式2KOH (aq)+H2SO4 (aq)=K2SO4(aq)+2H2O (l)△H=-114.6 kJ/mol |
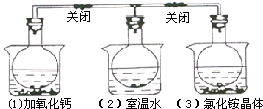 如图所示,三个烧瓶中分别充满NO2气体,并分别放置在盛有下列物质的烧杯中(烧杯内有水):在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )
如图所示,三个烧瓶中分别充满NO2气体,并分别放置在盛有下列物质的烧杯中(烧杯内有水):在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )| A、烧瓶(3)中气体的压强增大 |
| B、NH4Cl溶于水时放出热量 |
| C、烧瓶(1)中平衡时混合气体的平均相对分子质量增大 |
| D、2NO2?N2O4是放热反应 |
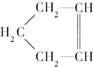 可简写为
可简写为 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为: