题目内容
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2
2NH3,下列有关说法正确的是( )
| 高温、高压 |
| 催化剂 |
| A、达到化学平衡时,N2将完全转化为NH3 |
| B、达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C、达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D、达到化学平衡时,正反应和逆反应的速率都为零 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:可逆反应反应物不能完全反应,达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析.
解答:
解:A、可逆反应反应物不能完全反应,故A错误;
B、反应平衡时各物质的浓度是否相等取决于起始时各物质的量的关系和转化的程度,N2、H2按1:3混合,化学计量数为1:3,所以转化率相等,平衡时,N2、H2的物质的量浓度一定为1:3,故B错误;
C、随反应进行,N2、H2和NH3的物质的量浓度发生变化,N2、H2和NH3的物质的量浓度不再变化,说明到达平衡状态,故C正确;
D、可逆反应时动态平衡,达到化学平衡时,正反应和逆反应的速率,但不为零,故D错误.
故选C.
B、反应平衡时各物质的浓度是否相等取决于起始时各物质的量的关系和转化的程度,N2、H2按1:3混合,化学计量数为1:3,所以转化率相等,平衡时,N2、H2的物质的量浓度一定为1:3,故B错误;
C、随反应进行,N2、H2和NH3的物质的量浓度发生变化,N2、H2和NH3的物质的量浓度不再变化,说明到达平衡状态,故C正确;
D、可逆反应时动态平衡,达到化学平衡时,正反应和逆反应的速率,但不为零,故D错误.
故选C.
点评:本题考查平衡状态的判断,选择判断的标准应随反应进行变化,当该标准不再变化说明到达平衡状态.

练习册系列答案
相关题目
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A、称量时NaOH已经潮解 |
| B、向容量瓶中转移溶液时,容量瓶事先用蒸馏水洗涤过 |
| C、定容时俯视容量瓶的刻度线 |
| D、定容摇匀后,有少量溶液外流 |
高温下,某反应达到平衡,平衡常数K=
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应的焓变为正值 | |||
| B、恒温恒容下,增大压强,H2浓度一定减小 | |||
| C、升高温度,逆反应速率减小 | |||
D、该反应的化学方程式为CO+H2O
|
四种基本反应类型中,一定是氧化还原反应的是( )
| A、化合反应 | B、分解反应 |
| C、置换反应 | D、复分解反应 |
已知2Zn(s)+O2(g)=2ZnO(s)△H=-700kJ/mol,则1g Zn在氧气中燃烧放出的热量约为( )
| A、5.4 kJ |
| B、350 kJ |
| C、3.5 kJ |
| D、8.5 kJ |
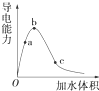 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.