题目内容
15. 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
①该反应在高温下能自发进行的原因是△S>0
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是BDF(填字母,下同).
A.容器中的压强不变 B.1mol H-H 键断裂的同时断裂2mol H-O 键
C.V (CO)=V (H2)D.密闭容器的容积不再改变
E.消耗1mol 水的同时生成1mol H2 F.容器的密度不变
③该反应的平衡常数的表达式K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$.
(2)水煤气再进一步反应可制取氢气.反应为H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的逆反应平衡常数K=$\frac{4}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是B.
| 起始 浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
B.平衡时,甲中和丙中H2的转化率不等
C.平衡时,丙中c(CO2)是甲中的2 倍
D.平衡时,乙中CO2的转化率大于60%
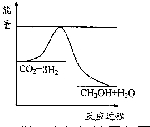
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L 的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)减小的是A.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来
D.再充入1mol CO2 和3mol H2.
分析 (1)①在高温下能自发进行,根据△G=△H-T△S<0判断;
②结合平衡的特征“等、定”及衍生的物理量判断,始终不变的量不能判定平衡状态;
③K是生成物的浓度幂与反应物浓度幂之积的比;
(2)A.丙中浓度最大,甲中浓度最小,浓度越大,反应速率越大;
B. 以甲计算:
H2O(g)+CO(g)?H2(g)+CO2(g)
起始:0 0 0.010 0.010
转化:x x x x
平衡:x x 0.01-x 0.01-x
则$\frac{(0.01-x)^{2}}{{x}^{2}}$=$\frac{4}{9}$,
x=0.006,结合等效平衡状态计算;
C.由B计算可知,平衡时,丙中的c(CO2)是甲中的2倍;
D.乙与甲相比较,相当于在甲的基础上通入H2,则平衡向逆反应方向移动;
(3)A.该反应为放热反应,升高温度,平衡逆向移动;
B.充入He(g),使体系压强增大,但各组分的浓度不变;
C.将H2O(g)从体系中分离出来,生成物浓度减小;
D.再充入1mol CO2 和3mol H2,两边的气体计量数相等,所以平衡时各组分的物质的量是原来的2倍.
解答 解:(1)①在高温下能自发进行,根据△G=△H-T△S<0,而该反应中△H>0,所以△S>0,故答案为:△S>0;
②A.在一个容积可变的密闭容器,容器中的压强始终不变,故A错误;
B.1mol H-H 键断裂等效于生成2mol H-O 键同时断裂2mol H-O 键,正逆反应速率相等,故B正确;
C.V (CO)=V (H2)只要反应发生就符合V (CO)=V (H2),故C错误;
D.密闭容器的容积不再改变,说明气体的物质的量不变,达平衡状态,故D正确;
E.消耗1mol 水的同时生成1mol H2,都反应的是正反应方向,故E错误;
F.容器的密度不变,说明气体的摩尔质量不变,反应达平衡状态,故F正确;
故答案为:BDF;
③平衡常数是生成物的浓度幂与反应物浓度幂之积的比,平衡常数的表达式K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$,故答案为:$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$;
(2)A.丙中浓度最大,甲中浓度最小,浓度越大,反应速率越大,则反应开始时,丙中的反应速率最快,甲中的反应最慢,故A正确;
B. 以甲计算:
H2O(g)+CO(g)?H2(g)+CO2(g)
起始:0 0 0.010 0.010
转化:x x x x
平衡:x x 0.01-x 0.01-x
则$\frac{(0.01-x)^{2}}{{x}^{2}}$=$\frac{4}{9}$,
x=0.006,则平衡时甲中的H2的转化率均是$\frac{0.006}{0.01}$×100%=60%,由于甲和丙的气体的比值相同,为等效平衡状态,则丙中H2的转化率也为60%,故B错误;
C.由B计算可知,平衡时,丙中的c(CO2)是甲中的2倍,应为2×(0.01-0.006)mol/L=0.008mol/L,故C正确;
D.乙与甲相比较,相当于在甲的基础上通入H2,则平衡向逆反应方向移动,平衡时,乙中的CO2的转化率大于60%,故D正确.
故答案为:B;
(3)A.升高温度,平衡逆向移动,能使c(CH3OH)减小,故A正确;
B.充入He(g),使体系压强增大,但各组分的浓度不变,平衡不移动,故B错误;
C.将H2O(g)从体系中分离出来,平衡正向移动,故C错误;
D.再充入1mol CO2 和3mol H2,两边的气体计量数相等,所以平衡时各组分的物质的量是原来的2倍,所以浓度不变,故D错误;
故答案为:A.
点评 本题考查化学平衡的计算,为高频考点,把握K的意义、化学平衡移动为解答的关键,侧重分析与应用能力的考查,注意平衡常数表达式中不能出现固体,题目难度不大.

 某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )
某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )| A. | 2min内,X的平均反应速率为0.25mol/(L•min) | |
| B. | 第5min时,该反应达到平衡状态 | |
| C. | 第5min后,Y的生成速率与X的消耗速率相等且保持不变 | |
| D. | 5min内,反应放出的热量为1.6QkJ |
| A. | MgO和Al2O3在工业上用于制作耐高温材料,也可用于电解法冶炼Mg、Al | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 医疗上用的“钡餐”其成分是碳酸钡,漂白粉的成分为次氯酸钙 | |
| D. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 |
(1)D元素的符号是O,C元素组成的单质C2的电子式是
 .
.(2)2016年10月17日7:30分在甘肃的酒泉卫星发射基地,我国成功发射“神舟十一号”载人飞船.火箭的发动机燃料更新为液态偏二甲肼(分子式为C2H8N2),氧化剂为液态的C2D4,燃烧后产物对环境无污染.写出偏二甲肼与C2D4反应的化学方程式:C2H8N2+2N2O4=3N2+4H2O+2CO2
(3)C2A4可作为火箭发动机的燃料,与氧化剂C2D4反应生成C2和A2D.已知:
①C2(g)+2D2(g)═C2D4(l)△H1═-19.5kJ/mol
②C2A4(l)+D2(g)═C2(g)+2A2D(g)△H2═-534.2kJ/mol
写出液体燃料C2A4与液态C2D4反应的热化学方程式:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
(4)在230℃和催化剂存在的条件下,将BD2与A2转化为BA3DA(g)和A2D(g).如图为生产1mol BA3DA(g)的能量变化示意图:
已知破坏1mol不同共价键的能量(kJ)分别是:
| B-A | B-D | B=D | A-A | A-D |
| 413.4 | 351 | 745 | 436 | 462.8 |

②已知E1=8.2kJ•mol-1,则E2=189.8kJ•mol-1.
| A. | ${\;}_{83}^{209}$Bi 和${\;}_{83}^{210}$Bi都含有83个中子 | |
| B. | 同位素:H2、D2、T2 | |
| C. | H2O和NH3分子中具有相同的质子数和电子数 | |
| D. | 稀有气体的原子最外层都达到8电子稳定结构,故都不能与别的物质发生反应 |

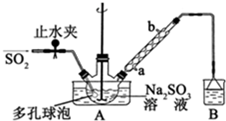
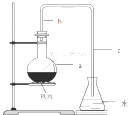 中学实验室用如图所示装置制取少量溴苯.请填写下列空白.
中学实验室用如图所示装置制取少量溴苯.请填写下列空白.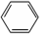 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$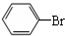 +HBr.
+HBr.