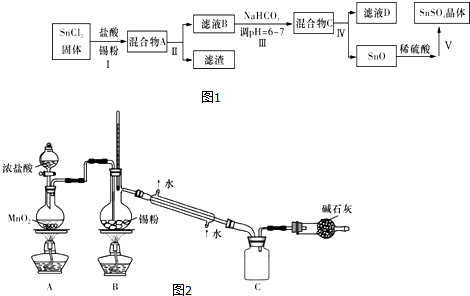
题目内容
19.下列关于钠及其化合物的说法错误的是( )| A. | 钠、过氧化钠、氢氧化钠、碳酸钠灼烧时火焰呈黄色 | |
| B. | 切开的金属钠暴露在空气中,光亮的表面变暗发生2Na+O2═Na2O2反应 | |
| C. | 过氧化钠可用作呼吸面具和潜水艇中做氧气的来源 | |
| D. | 过氧化钠投入硫酸铜溶液可产生氢氧化铜沉淀和氧气 |
分析 A.钠的焰色为黄色,焰色反应为元素性质;
B.钠与氧气常温下反应生成氧化钠;
C.过氧化钠与水、二氧化碳反应生成氧气;
D.过氧化钠投入硫酸铜溶液反应生成氢氧化铜,硫酸钠和氧气.
解答 解:A.焰色反应为元素性质,钠的焰色为黄色,故A正确;
B.切开的金属钠暴露在空气中,光亮的表面变暗发生4Na+O2═2Na2O反应,故B错误;
C.过过氧化钠与水、二氧化碳反应生成氧气,可用作呼吸面具和潜水艇中做氧气的来源,故C正确;
D.过氧化钠投入硫酸铜溶液反应生成氢氧化铜,硫酸钠和氧气,所以看到现象,产生氢氧化铜沉淀和氧气,故D正确;
故选:B.
点评 本题考查了物质的性质,熟悉钠、过氧化钠的性质是解题关键,注意焰色反应属于元素的性质,题目难度不大.

练习册系列答案
相关题目
10. 某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )
某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )
 某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )
某温度时,反应X(g)=4Y(g)+Z(g)△H=-QkJ/mol,在2L的恒容密闭容器中进行,X的浓度随时间变化如图所示.下列说法不正确的是( )| A. | 2min内,X的平均反应速率为0.25mol/(L•min) | |
| B. | 第5min时,该反应达到平衡状态 | |
| C. | 第5min后,Y的生成速率与X的消耗速率相等且保持不变 | |
| D. | 5min内,反应放出的热量为1.6QkJ |
7.化学与人类生产、生活、社会可持续发展密切相关.下列有关说法正确的是( )
| A. | MgO和Al2O3在工业上用于制作耐高温材料,也可用于电解法冶炼Mg、Al | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 医疗上用的“钡餐”其成分是碳酸钡,漂白粉的成分为次氯酸钙 | |
| D. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 |
14.用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是( )
| A. | 干燥的 | B. | 不漏水的 | ||
| C. | 用欲配制的溶液润洗过的 | D. | 标有刻度的 |
4.A、B、C、D是元素周期表中的短周期元素,且原子序数依次增大.A元素原子中无中子,B元素的一种同位素常用于文物考古,且该元素形成的化合物种类最多,D元素的原子核外最外层电子数是次外层电子数的三倍.回答下列问题:
(1)D元素的符号是O,C元素组成的单质C2的电子式是 .
.
(2)2016年10月17日7:30分在甘肃的酒泉卫星发射基地,我国成功发射“神舟十一号”载人飞船.火箭的发动机燃料更新为液态偏二甲肼(分子式为C2H8N2),氧化剂为液态的C2D4,燃烧后产物对环境无污染.写出偏二甲肼与C2D4反应的化学方程式:C2H8N2+2N2O4=3N2+4H2O+2CO2
(3)C2A4可作为火箭发动机的燃料,与氧化剂C2D4反应生成C2和A2D.已知:
①C2(g)+2D2(g)═C2D4(l)△H1═-19.5kJ/mol
②C2A4(l)+D2(g)═C2(g)+2A2D(g)△H2═-534.2kJ/mol
写出液体燃料C2A4与液态C2D4反应的热化学方程式:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
(4)在230℃和催化剂存在的条件下,将BD2与A2转化为BA3DA(g)和A2D(g).如图为生产1mol BA3DA(g)的能量变化示意图:
已知破坏1mol不同共价键的能量(kJ)分别是:
①写出BD2和A2转化为1mol BA3DA(g)和A2D(g)的热化学方程式:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H═-181.6kJ/mol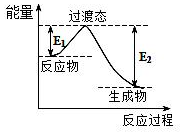
②已知E1=8.2kJ•mol-1,则E2=189.8kJ•mol-1.
(1)D元素的符号是O,C元素组成的单质C2的电子式是
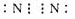 .
.(2)2016年10月17日7:30分在甘肃的酒泉卫星发射基地,我国成功发射“神舟十一号”载人飞船.火箭的发动机燃料更新为液态偏二甲肼(分子式为C2H8N2),氧化剂为液态的C2D4,燃烧后产物对环境无污染.写出偏二甲肼与C2D4反应的化学方程式:C2H8N2+2N2O4=3N2+4H2O+2CO2
(3)C2A4可作为火箭发动机的燃料,与氧化剂C2D4反应生成C2和A2D.已知:
①C2(g)+2D2(g)═C2D4(l)△H1═-19.5kJ/mol
②C2A4(l)+D2(g)═C2(g)+2A2D(g)△H2═-534.2kJ/mol
写出液体燃料C2A4与液态C2D4反应的热化学方程式:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
(4)在230℃和催化剂存在的条件下,将BD2与A2转化为BA3DA(g)和A2D(g).如图为生产1mol BA3DA(g)的能量变化示意图:
已知破坏1mol不同共价键的能量(kJ)分别是:
| B-A | B-D | B=D | A-A | A-D |
| 413.4 | 351 | 745 | 436 | 462.8 |

②已知E1=8.2kJ•mol-1,则E2=189.8kJ•mol-1.
11.下列操作不能达成实验目的是( )
| A. | 溴乙烷与氢氧化钠溶液共煮后,加入硝酸银检验Br- | |
| B. | 用电石和饱和食盐水制取乙炔 | |
| C. | 用苯、12mol/L的硝酸和18mol/L的硫酸制硝基苯 | |
| D. | 用稀硝酸洗涤做过银镜反应的试管 |